Metilaminstruktur, egenskaper, produksjon, bruk
- 4258
- 305
- Thomas Karlsen
De Metilamin Det er en organisk forbindelse med kondensert formel3NH2. Spesielt er det den enkleste primære alkyamin av alle, da den bare inneholder en alquilisk substituent, som er det samme som å si at det bare er en C-N-kovalent lenke.
Under normale forhold er det en ammoniakkgass som lukter fisk, men det er relativt enkelt å kondensere og transportere i hermetiske tanker. På samme måte kan det oppløses betydelig i vann, og forårsaker gulaktige løsninger. På den annen side kan det også transporteres som solid i form av hydrokloridsaltet ditt, CH3NH2· HCl.
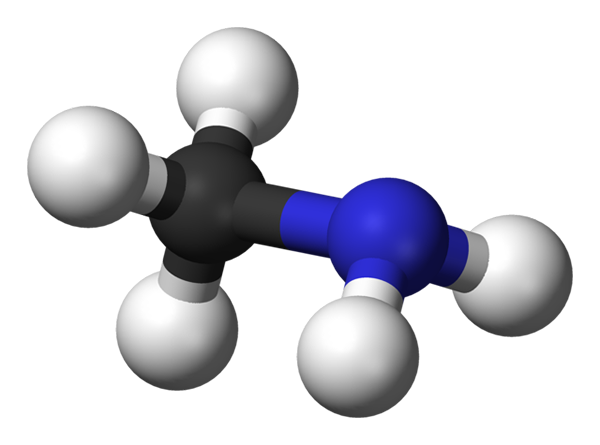
 Metilaminmolekyl. Kilde: Benjah-BMM27 via Wikipedia.
Metilaminmolekyl. Kilde: Benjah-BMM27 via Wikipedia. Metilamin forekommer industrielt fra ammoniakk og metanol, selv om det er mange andre produksjonsmetoder på laboratorieskalaer. Gassen er svært eksplosiv, så enhver varmekilde nær den har potensial til å forårsake en stor brann.
Det er en forbindelse med høy kommersiell etterspørsel, men samtidig presenterer den sterke juridiske begrensninger fordi det fungerer som råstoff for medisiner og psykotropiske stoffer.
[TOC]
Struktur
Bildet over viser molekylstrukturen til metylaminet representert av en modell av kuler og søyler. Den svarte sfæren tilsvarer karbonatomet, det blå til nitrogenatomet og det hvite til hydrogenatomene. Det er derfor et lite molekyl, der metan, Cho4, Mister en H for en NH -gruppe2, gir Ch3NH2.
Metilamin er et sterkt polært molekyl, fordi nitrogenatom tiltrekker elektronisk karbontetthet og hydrogenatomer. Den har muligheten til også å danne hydrogenbroer mellom kompendiet til dets intermolekylære krefter. Hvert molekyl av CH3NH2 Du kan donere eller godta en påfølgende hydrogenbro (CH3HNH-NH2Ch3).
Kan tjene deg: Hva er bandteori?Imidlertid er molekylmassen betydelig lav, i tillegg til portene CH3 De hindrer slike hydrogenbroer. Resultatet er at metylamin er en gass under normale forhold, men det kan kondenseres ved en temperatur på -6 ºC. Når du krystalliserer, gjør det det etter en ortorrombisk struktur.
Egenskaper
Fysisk utseende
Fargerik gass eller væske, men hvis vandige oppløsninger kan presentere gulaktige toner.
Lukt
Ubehagelig, lik den for en blanding av fisk og ammoniakk.
Molmasse
31.058 g/mol
Smeltepunkt
-93.10 ºC
Kokepunkt
Rundt -6 ºC. Derfor er det en gass som kan kondensere ved ikke for kalde temperaturer.
Tetthet
656,2 kg/m3 ved 25 ºC. Dampene er 1,1 ganger tett enn luft, mens dens væske eller kondensat er omtrent 0,89 ganger mindre tett enn vann.
Damptrykk
Ved romtemperatur varierer damptrykket ditt 3,5 atm.
Dipolar øyeblikk
1,31 d
Vannløselighet
1.080 g/l ved 20 ºC. Det er en gass som løses veldig bra i vann, fordi begge molekyler er polare og relatert til hverandre når de etablerer hydrogenbroer (CH3Hnh-oh2).
Grunnleggende
Metilamin har en grunnleggende konstant (PKb) av 3,36. Denne verdien indikerer at det er et betydelig grunnleggende stoff, enda mer enn den samme ammoniakk, så det oppløst i vann frigjør en viss mengde OH -ioner- Når hydrolysiserte:
Ch3NH2 + H2Eller ⇌ Ch3NH3+ + Åh-
Metilamin er mer grunnleggende enn ammoniakk fordi nitrogenatomet har større elektronisk tetthet. Dette er fordi Cho3 Gjort mer nitrogenelektroner enn de tre hydrogenatomene i NH -molekylet3. Likevel regnes metyilamin som en svak base foran andre alkyaminer eller aminer.
Kan tjene deg: CO2 Link TypeFlash Point
-10 ºC til en lukket kopp, noe som betyr at det er en svært brennbar og farlig gass.
Selvordemperatur
430 ºC
Overflatespenning
19,15 mn/m a 25 ºC
Nedbrytning
Når forbrenninger er det termisk dekomponert i karbon- og nitrogenoksider, som danner en giftig røyk.
Produksjon
Metilamin kan produseres eller syntetiseres enten ved den kommersielle eller industrielle metoden, eller ved laboratoriemetoder ved lavere skalaer.
Industriell
Metilamin forekommer industrielt gjennom reaksjonen som foregår mellom ammoniakk og metanol på en katalytisk sympatisk gelstøtte. Den kjemiske ligningen for denne reaksjonen er som følger:
Ch3OH + NH3 → Ch3NH2 + H2ENTEN
I prosessen kan andre alkaminer genereres; Metyilamin er imidlertid produktet som kinenetisk ser mer favorisert.
Laboratorium
På laboratorietivå er det flere metoder som tillater syntetisering av liten metylamin. En av dem er reaksjonen i et sterkt basismedium, av KOH, mellom acetamid og brom, hvor metylisocianat genereres, CH3NCO, som igjen er hydrolysert for å bli metylering.
Metilamin kan lagres som et fast stoff hvis nøytraliseres med saltsyre, slik at det dannes et hydrokloridsaltform:
Ch3NH2 + HCl → Ch3NH2· HCl
Deretter er metylaminhydroklorid, også representert som [CH3NH3] CL, kan være basert på et trygt sted å oppnå den vandige oppløsningen med oppløst gass:
[Ch3NH3] Cl + NaOH → CH3NH2 + NaCl + H2ENTEN
På den annen side kan metylamin også syntetiseres fra heksamin, (CH2)6N4, som er direkte hydrolysert med saltsyre:
Kan tjene deg: krystallisering(Ch2)6N4 + HCl + 6 H2O → 4 nh4CL + 6 CH2ENTEN
Etter hverandre reagerer ammoniumklorid med varm formaldehyd for å forårsake metyilamin og maursyre -damper, HCOOH.
Metylamin kan også oppnås ved å redusere nitrometan, CH3NEI2 med metallisk sink og saltsyre.
applikasjoner
 Efedrin er et medisiner som trenger metyilamin for kommersiell produksjon. Kilde: Turkeyphant.
Efedrin er et medisiner som trenger metyilamin for kommersiell produksjon. Kilde: Turkeyphant. Metilamin er en forbindelse hvis bruk vanligvis genererer kontrovers, ettersom det er et stoff som brukes i narkotika -syntese som metamfetamin. Faktisk skyldes populariteten ønsket om at hovedpersonene i den breaking Bad -TV -serien måtte få det til enhver pris.
Denne forbindelsen brukes også som råstoff for produksjon av insektmidler, medisiner, overflateaktive midler, eksplosiver, fargestoffer, soppdrepende midler, tilsetningsstoffer, etc., Så det har en sterk verdensetterspørsel, i tillegg til flere juridiske begrensninger for anskaffelsen.
Den enorme kjemiske allsidigheten skyldes CHO -molekylet3NH2 Det er et godt nukleofilt middel, koblet eller koordinert til underlag av større molekylmasse i flere organiske reaksjoner. For eksempel er dette basert på syntesen av efedrinet, der Cho3NH2 Den blir sammen med et molekyl med det påfølgende tapet av en H.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Metylamin. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Metylamin. PubChem -database., CID = 6329. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Dylan Matthews. (15. august 2013). Her er hva 'Breaking Bad' blir riktig, og galt, om meth -virksomheten. Gjenopprettet fra: WashingtonPost.com
- Prepchem. (2020). Forberedelse av metylaminhydroklorid. Gjenopprettet fra: Prepchem.com

