Nitrilegenskaper, nomenklatur, bruk, eksempler

- 1593
- 350
- Theodor Anders Hopland
De Nitriles De er alle de organiske forbindelsene som har CN -funksjonell gruppe, som også kalles en cyanogruppe, eller cyanid når det gjelder uorganisk kjemi. Alifatiske nitrils er representert med RCN General Formula, mens aromatiske nitriler med ARCN -formelen.
Selv om hydrogensyanid, HCN og cyanidmetallsalter er svært giftige forbindelser, skjer nøyaktig det samme med nitriler. CN -gruppen i et karbonskjelett av noe slag (forgrenet, lineær, aromatisk, etc.), oppfører det seg diagonalt forskjellig fra en cyanidanion, CN-.
 Generell formel for en alifatisk nitril. Kilde: Benjah-BMM27 via Wikipedia.
Generell formel for en alifatisk nitril. Kilde: Benjah-BMM27 via Wikipedia. Nitriler er veldig formidlet i plastverdenen, ettersom flere av dem stammer fra Acrilonitril, CH2CHCN, en nitril som polymerer syntetiseres som nitrilgummier, brukes til å lage kirurgi eller laboratoriehansker. Nitriler er også til stede i mange naturlige og farmasøytiske produkter.
På den annen side er nitriler forløpere av karboksylsyrer, siden deres hydrolyse representerer en alternativ syntese metode for å oppnå sistnevnte.
[TOC]
Egenskaper og egenskaper
Struktur
Molekylære strukturer i nitrilene varierer avhengig av identiteten til henholdsvis R eller AR i RCN- eller ARCN -forbindelsene.
Imidlertid er CN -gruppens geometri lineær på grunn av dens trippelkobling, C≡N, som er et produkt av SP -hybridisering. Dermed er C-C-atomer plassert i samme linje. Utover disse atomene kan det være noen struktur.
Polaritet
Nitriler er polare forbindelser, siden nitrogen av CN -gruppen er veldig elektronegativ og tiltrekker elektroner mot seg selv. Derfor har de fusjons- eller kokepunkter høyere enn homologene sine for.
Det kan tjene deg: Scandio: Historie, egenskaper, reaksjoner, risikoer og bruksområderFor eksempel acetonitril, cho3CN, det er en væske som koker ved 82 ºC; Mens Etano, CH3Ch3, Det er en gass som koker på -89 ºC. Legg merke til den store effekten som CN -gruppen har på intermolekylære interaksjoner.
Den samme resonnementet gjelder større forbindelser: Hvis de har en eller flere CN -grupper i strukturen, er det ganske sannsynlig at polariteten deres vil øke og være mer relatert til overflater eller polare væsker.
Grunnleggende
Det kan antas at på grunn av den høye polariteten til nitriler, er dette relativt sterke baser foran aminene. Vi må imidlertid ta hensyn til de Covalente bindinger, og det faktum at både karbon og hydrogen har SP -hybridisering.
Grunnaliteten til RCN: Det er representert ved å akseptere et proton fra vannet: Vann:
RCN: + H2Eller ⇌ rcnh+ + Åh-
For å prota RCN: det elektronfrie dreiemomentet på nitrogenet må danne en kobling med ionen H+. Men det er en ulempe: nitrogenhybridisering gjør det for elektronegativt, så mye at dette elektronparet er veldig sterkt tiltrukket og ikke engang tillater en binding å danne.
Derfor sies det at nitrogen -sperparet av nitrogen ikke er tilgjengelig, og at nitrilens basisitet er veldig lav. Faktisk er nitriler millioner av ganger mindre grunnleggende enn aminer.
Reaktivitet
Blant de mest representative reaksjonene av nitriler har vi deres hydrolyse og reduksjon. Denne hydrolysen er mediert av surheten eller basisiteten i det vandige miljøet, og forårsaker henholdsvis en karboksylsyre eller et karboksylatsalt:
Kan tjene deg: væskedampbalanseRCN + 2H2O + HCl → RCOOH + NH4Cl
RCN + H2O + NaOH → RCONA + NH3
I prosessen dannes også en amida.
Nitriler reduseres til aminer ved bruk av hydrogen- og metallkatalysatorer:
RCN → RCH2NH2
Nomenklatur
I følge IUPAC -nomenklaturen blir nitriler navngitt ved å legge til suffikset -nitril til navnet på alkankjeden som den stammer fra, også inkludert karbonet i cyano. Dermed Cho3CN kalles Ethanonitrilo, og Cho3Ch2Ch2CN, Butanonitril.
De kan også utnevnes fra navnet karboksylsyre, som elimineres av ordet 'syre', og suffikser erstattes -oic eller -oico av suffikset -onitril. For eksempel for CH3CN ville være acetonitril (eddiksyre); For c6H5CN, det ville være benzonitril (av benzosyre); Og for ham (Cho3)2CHCN, 2-metylpropanitril.
Alternativt, hvis navnene på alquilician -substituenter vurderes, kan nitriler nevnes ved å bruke ordet 'cyanid'. For eksempel Cho3CN vil da bli kalt metylcyanid, og (cho3)2CHCN, isopropylcyanid.
applikasjoner
Nitriler er en del av naturlige produkter, å være i bitre mandler, i bein av forskjellige frukt, hos marine dyr, planter og bakterier.
CN -gruppene utgjør strukturene til cyanogene lipider og glykosider, biomolekyler som når de blir nedbrutt frigjør hydrogensyanid, HCN, en meget giftig gass. Derfor har de en overhengende biologisk bruk for visse skapninger.
Det ble tidligere sagt at CN -grupper gir mye polaritet til molekylene, og faktisk går de ikke upåaktet hen når de er til stede i forbindelser med farmakologisk aktivitet. Slike nitrilmedisiner har blitt brukt for å bekjempe hyperglykemi, brystkreft, diabetes, psykose, depresjon og andre lidelser.
Kan tjene deg: irreversibel reaksjon: Kjennetegn og eksemplerIn addition to having a role in biology and medicine, they industrially make up a handful of nitrile plastics, with which surgical and laboratory gloves are made, stamps of automotive parts, hoses and joints due to their resistance against corrosion and fats, Materials such as Tupperware, musikkinstrumenter eller Legos -blokker.
Nitrileksempler
Neste og til slutt vil noen eksempler på nitriler bli oppført.
Nitrilgummier
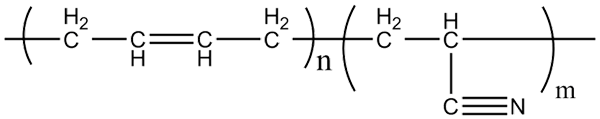 Molekylær struktur av akrilonitril-butadien-kopolymerer. Kilde: Klever via Wikipedia.
Molekylær struktur av akrilonitril-butadien-kopolymerer. Kilde: Klever via Wikipedia. Nitrilgummi, som de nevnte hansker og fett -resistente materialer produseres, er en kopolymer dannet av akrilonitril og butadien (over). Legg merke til hvor lineær CN -gruppen ser ut.
Ciamemazine
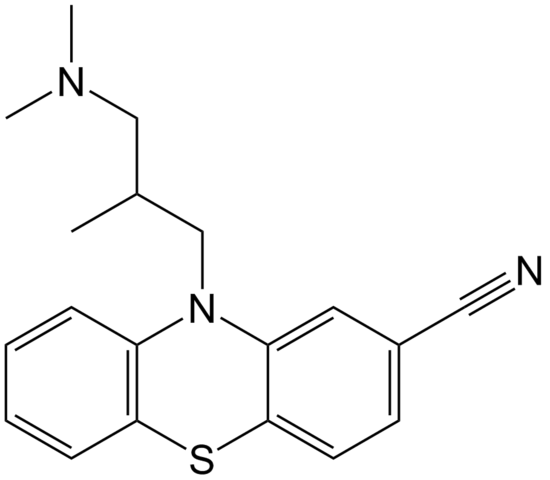 Molekylær struktur av cipemazin. Kilde: EPOP / PUB -domene
Molekylær struktur av cipemazin. Kilde: EPOP / PUB -domene Cyammazin er et eksempel på en nitril i apotekområdet som brukes som antipsykotisk, spesielt for å behandle angst- og schizofreni -lidelser. Igjen, legg merke til lineariteten til CN -gruppen.
Citalopram
 Et annet nitrilmedisin er citalopram, brukt som antidepressiva
Et annet nitrilmedisin er citalopram, brukt som antidepressiva Amygdalin
 Molekylær struktur i mandlene. Kilde: Wesalius / Public Domain
Molekylær struktur i mandlene. Kilde: Wesalius / Public Domain Tonsil er et eksempel på en cyanogen glukóside. Det finnes i bitre mandler, plommer, aprikoser og fersken. Legg merke til hvor liten CN -gruppen ser ut til resten av strukturen; Likevel er dens eneste tilstedeværelse nok til å gi en unik kjemisk identitet til dette karbohydratet.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitril. Hentet fra: i.Wikipedia.org
- Kjemi librettexts. (5. juni 2019). Kjemi av nitriler. Gjenopprettet fra: Chem.Librettexts.org
- Jim Clark. (2016). Hydrolyserende nitriler. Gjenopprettet fra: Chemguide.co.Storbritannia
- Ivy Rose Holistic. (2020). Nitrilnavn. Hentet fra: Ivyrose.com
- Germán Fernández. (s.F.). Nitril Nomenklatur: IUPAC -regler. Gjenopprettet fra: Chemicicaorganica.org
- « De 8 viktigste psykologiske strømningene og deres forfattere
- Metilaminstruktur, egenskaper, produksjon, bruk »

