Gjeldende atommodell

- 3093
- 102
- Magnus Sander Berntsen
Hva er den nåværende atommodellen?
Han Gjeldende atommodell Det er den som er basert på kvantemekanikk, spesielt i Schrödinger -ligningen, i prinsippet om ekskludering av Pauli og en egenskap av elektronet som kalles snurre rundt enten Espin.
Det er modellen for størst aksept og bruk i studiet av strukturen til atomer, molekyler og i den kjemiske reaktiviteten til elementene, på grunn av presisjonen i deres spådommer og deres relative enkelhet.
 Figur 1. Hydrogenatom i en opphisset tilstand og dets atomnummer: energi n = 4, vinkelmoment l = 3 og magnetisk moment m = 1. Kilde: Wikimedia Commons.
Figur 1. Hydrogenatom i en opphisset tilstand og dets atomnummer: energi n = 4, vinkelmoment l = 3 og magnetisk moment m = 1. Kilde: Wikimedia Commons. Denne modellen er utviklingen av flere tidligere atommodeller, for eksempel Rutherford -modellen og den fra Bohr - Sommerfeld, betraktet som klassiske eller semi -klassiske modeller.
Det er for øyeblikket teoretisk mer komplette modeller enn Schrödingers typisiske modell, for eksempel Dirac-Jordan-modellen, som inneholder spesiell relativitet og er basert på Dirac Wave-ligningen. I denne ligningen vises spinnet, egenskapen til elektronene som er nevnt i begynnelsen, vises naturlig.
Det er også modeller basert på kvantefeltteori, brukt i fysikk med høy energi. Disse modellene er utmerkede i prediksjonen om skapelse og utslettelse av grunnleggende partikler, målet med dette fysikkfeltet.
Det er verdt å nevne at de mest sofistikerte teoriene konvergerer til de samme resultatene som for Schrödinger -ligningen, spesielt for lette atomer.
Gjeldende atommodellegenskaper
I visjonen om det nåværende atomet, basert på ikke-relativistisk kvantum, er det ikke noe begrep om elektroniske baner i stil med planetariske systemer.
Imidlertid er det mest utbredte bildet av atom. Men til tross for røttene, tilsvarer det ikke lenger den nåværende atommodellen.
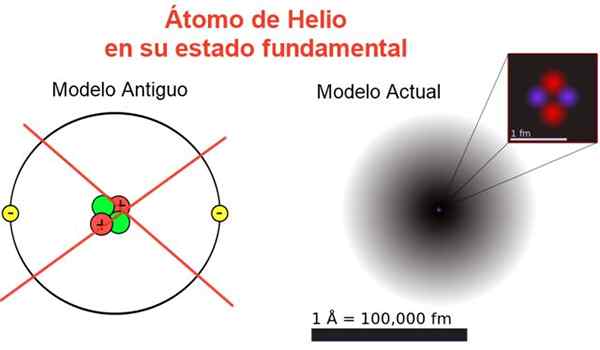 Figur 2. Klassisk og nåværende bilde av heliumatom i sin grunnleggende tilstand. I den nåværende modellen er de to elektronene i heliumatom spredt i et område som kalles orbital. Kilde: Wikimedia Commons, din egen komposisjon.
Figur 2. Klassisk og nåværende bilde av heliumatom i sin grunnleggende tilstand. I den nåværende modellen er de to elektronene i heliumatom spredt i et område som kalles orbital. Kilde: Wikimedia Commons, din egen komposisjon. Figur 2 viser det gamle bildet og det nåværende bildet av et heliumatom i dets mindre energitilstand (nivå n = 1 og l = 0).
Det kan tjene deg: Gjennomsnittlig akselerasjon: Hvordan den beregnes og løsesDet klassiske bildet er nyttig for å se at kjernen inneholder to protoner og to nøytroner. Garanti atomets nøytralitet er det to elektroner som okkuperer samme energinivå.
Fra resten er det et bilde borte fra virkeligheten, siden kjernenes omfang ikke engang tilsvarer atomets atom: kjernen er 1/100000 ganger atomets størrelse, men det er der atommassen er konsentrert.
Onda dualitet - partikkel
Klassisk mekanikk slår fast at hver materiell partikkel har en tilknyttet bølge, kalt Bølgefunksjon. Dette er den berømte Onda-partikkel dualitet fra Louis de Broglie.
I den nåværende atommodellen er atferdens oppførsel i atomens skala er tydelig bølgende, mens på det makroskopiske nivået, slik som elektronene som beveger seg i katodestrålerørene til de gamle TV -ene, dominerer den korpuskulære atferden.
På den annen side, med fotoner, skjer det tvert imot, i de fleste optiske fenomener (på makroskopisk nivå) har de fundamentalt bølgende oppførsel. Og når de samhandler med spørsmål om materie, har de en partikkeloppførsel.
På grunn av dette er elektroner rundt kjernen spredt inn i områder som kalles Atomic orbitals, hvis form og utvidelse vil avhenge av energinivået til elektronene og vinkelmomentet.
Både energi og vinkelmomentumet til elektronet rundt kjernen har visse tillatte verdier, derfor sies det at de er kvantisert.
Schrödinger -bølge -ligningen forutsier hvilke energiverdier og vinkelmomentum som er tillatt, samt bølgefunksjonen assosiert med hver energi og momentumnivå.
Den matematiske kvadratet i bølgefunksjonen bestemmer orbitalene, det vil si områdene rundt kjernen der elektroner kan bli funnet mer sannsynlig.
Atomstørrelsen
For å ha et skala -bilde av den nåværende atommodellen, la oss forestille oss at et atom har en diameter som et fotballbane. Kjernen ville være som en maur i midten av feltet, men overraskende med 99,9% av atommassen.
På den annen side ville elektroner være like diffuse spøkelsesaktige spillere over hele feltet, med større sannsynlighet for å bli funnet på midtbanen.
Kan tjene deg: Kategorisk variabel: Kjennetegn og eksemplerDet er noen få justeringer eller tillater måter å okkupere feltet, som er avhengige av energien til spillerne (elektronene) og mengden "sving" eller snurr rundt sentrum.
Gjeldende atommodell postulerer
1.- Elektronet er preget av dets masse m, av dets spinn s Og for å være den elementære negative belastningsbærende partikkelen (-e).
2.- Elektronene har dobbel, bølgeformet oppførsel, men avhengig av deres energi og omfanget av fenomenet kan være mer overveiende enn det andre.
3.- Elektronene omgir den positive atomkjernen, slik at de garanterer atomets elektriske nøytralitet. Derfor er mengden elektroner lik den for protoner; Dette er atomnummer, som gir de kjemiske og fysiske egenskapene til hvert element.
4.- Samspillet mellom elektroner og kjerner er modellert av potensiell V (r) Coulombs elektrostatiske, som er integrert i begrepet potensiell energi i den Hamiltonian -operatøren.
5.- Begrepet kinetisk energi i Hamiltonian -operatøren er en operatør som er bygget fra den lineære momentumoperatøren, og er den samme:
p = - i ħ ∂ /∂r
Hvor ħ er Plancks konstant delt med 2π.
6.- Hamiltonian -operatøren H = (P⋅P)/2m - E V (r) handle på elektronbølgefunksjonen ψ (r).
7.- Når de stasjonære løsningene av den elektroniske bølgefunksjonen blir søkt, brukes den uavhengige Schrödinger -ligningen av tid:
H ψ (r) = E ψ (r)
Hvor E representerer elektronens totale energi.
8.- I atomer med flere elektroner blir ikke samspillet mellom dem tatt i betraktning.
9.- Når det gjelder atomer av mange elektroner, er orbitalene til de ytterste elektronene modellert av potensialet til den skjermet kjernen av de mest indre elektronene, som er kjent som Debye -potensialet.
10.- Ligning (7) har en løsning for noen diskrete energiverdier, slik at kjendiser Hvor mange fra Planck, De vises naturlig nok fra Schrödingers ligningsløsninger.
Det kan tjene deg: Stasjonære bølger: Formler, egenskaper, typer, eksemplerelleve.- For hver diskret verdi er det en bølgefunksjon. Men noen løsninger er degenerert, avhengig av verdien av vinkelmoment l.
12.- Bølgefunksjonen er produktet av en radiell funksjon, den azimutale funksjonen og polarfunksjonen.
1. 3.- Denne bølgefunksjonen bestemmer de tillatte regionene for elektronet. Kvadratet med bølgefunksjonen er sannsynlighetstetthet For å finne elektronet i en bestemt posisjon, sett fra sentrum av atomkjernen.
14.- Spinnet vises ikke i Schrödinger -ligningen, men er innlemmet i atommodellen gjennom Pauli -prinsippet:
Elektronet er en fermion med to mulige tilstander av spinn +½ og -½.
Så den samme tilstanden som er preget av kvantetall n, l, m av schrödinger -ligningen, kan være okkupert på det meste av 2 elektroner med motsetninger motsetninger. På denne måten blir Espin det fjerde kvantetallet.
Innflytelsesrike forskere i den nåværende atommodellen
Det virker utrolig, men de fleste av fysikerne som bidro til den nåværende atommodellen vises på samme bilde. De samlet seg på de berømte konferansene sponset av Ernest Solvay, en kjemiker og industri av belgisk opprinnelse, som ble berømt i vitenskapens verden.
De begynte å bli holdt siden 1911 og samlet øyeblikkets største forskere, blant dem var praktisk talt alle de som ga sitt bidrag til den nåværende atommodellen.
Den mest kjente av disse konferansene ble holdt i Brussel i 1927, og der ble dette historiske fotografiet tatt:
 Figur 3. 1927 Solvay Conference Deltakere i Brussel. Kilde: Wikimedia Commons.
Figur 3. 1927 Solvay Conference Deltakere i Brussel. Kilde: Wikimedia Commons.  Figur 4. Deltakerne på Solvay 1927 -konferansen.
Figur 4. Deltakerne på Solvay 1927 -konferansen. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Donder Théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max født
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Artikler av interesse
Schrödinger atommodell.
Broglie Atomic Model.
Chadwick Atomic Model.
Heisenberg Atomic Model.
Perrin Atomic Model.
Thomson Atomic Model.
Dalton Atomic Model.
Dirac Jordan Atomic Model.
Democritus Atomic Model.
Leucipo atommodell.
Bohr atommodell.
Referanser
- Alonso - Finn. Kvante- og statistiske fundamenter. Addison Wesley.
- Bauer, w. 2011. Fysikk for ingeniørfag og vitenskap. Volum 1. Mc Graw Hill.
- Eisberg og Resnick. Kvantefysikk. Limusa - Wiley.
- Wikipedia. Atomisk teori. Gjenopprettet fra: er.Wikipedia.com
- Zapata f. Typocuantic modell av atomet. Hentet fra: Lifer.com

