Molalitet
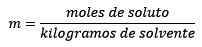
- 3860
- 1230
- Jonathan Moe
Hva er moleality?
De Molalitet, betegnet med bokstaven m i små bokstaver, er det et begrep som brukes for å beskrive konsentrasjonen av en løsning. Det kan defineres som antall mol av et løst stoff oppløst i 1 kilo løsningsmiddel.
Det er lik molene med løst stoff (stoffet som oppløses) delt med løsningsmiddelkilogene (stoffet som brukes til å oppløse).
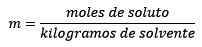
Hvor oppløst føflekker er gitt av ligningen:
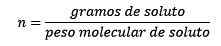
Så til slutt gjenstår molitetsligningen
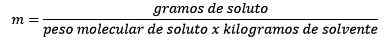
Kjennetegn på moleality
- Molalitet er et mål på konsentrasjonen av et løst stoff i en løsning. Brukes hovedsakelig når temperaturen er en bekymring.
- Molalitet er ikke så vanlig som dens motstykke, molaritet (mol oppløst for hver liter løsningsmiddel), men brukes i veldig spesifikke beregninger, spesielt med tanke på de kollegative egenskapene (forhøyning av kokepunktet, depresjon av frysingspunktet). Siden volumet er underlagt variasjon på grunn av temperatur og trykk, varierer molaritet også i henhold til temperatur og trykk.
- I noen tilfeller er vektbruk en fordel fordi massen ikke varierer med miljøforhold.
- Det er viktig at løsningsmiddelmassen og ikke massen av løsningen brukes.
- Løsningene merket med moralsk konsentrasjon er indikert med en små. En 1,0 m løsning inneholder 1 mol løst stoff per kilo løsningsmiddel.
- Forberedelse av en gitt moralløsning er enkel fordi den bare krever god skala. Både løsningsmidlet og løsningen er blandet, i stedet for å bli målt etter volum.
Det kan tjene deg: propansyre- SI -enheten (internasjonalt system) for føflekk er mol/kg, eller mol oppløst per kg løsningsmiddel. En løsning med en molitet på 1 mol/kg blir ofte beskrevet som "1 mol" eller "1 m".
Etter SI -enhetssystemet vurderer imidlertid National Institute of Standards and Technology, som er myndigheten til USA på måling, at begrepet "moralsk" og "M" enhetssymbolet er foreldet og antyder å bruke mol/kg.
Forskjeller og likheter mellom molealitet (M) og molaritet (M)
Utarbeidelse av en løsning av en gitt moral innebærer å veie både oppløsningen og løsningsmidlet og oppnå dets masser.
Men når det gjelder molaritet, måles volumet av løsningen, noe som etterlater plass for tetthetsvariasjoner som et resultat av miljø- og trykkforholdstilstanden.
Dette betyr at det er fordelaktig trykk mens deigen forblir uendret.
I tillegg finner kjemiske reaksjoner sted i masseandel, og ikke volum. For å stole på deigen, kan molealitet lett bli et masseforhold eller en massefraksjon.
For vandige oppløsninger (oppløsninger der vann er løsningsmiddel) nær omgivelsestemperatur, er forskjellen mellom moralske og molære oppløsninger foraktelig.
Dette er fordi rundt omgivelsestemperatur har vann en tetthet på 1 kg / l. Dette betyr at "av l" av molaritet er lik "av kg" av moleality.
Det kan tjene deg: kalsiumkaseinat: struktur, egenskaper, innhenting og brukFor et løsningsmiddel som etanol, hvor tettheten er 0,789 kg / l, vil en 1 m løsning være 0,789 m.
Den viktige delen av å huske forskjellen er:
Molaritet - M → mol per liter løsning.
Molalitet - M → Mol per kilo løsningsmiddel.
Eksempler på moleality
Eksempel 1
Problem: Hva er moralen i en løsning som inneholder 0.086 mol NaCl oppløst i 25,0 g vann?
Svar: I dette eksemplet brukes den direkte moralske ligningen:
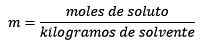
Mol oppløst (NaCl) = 0,086 mol
Masse (vann) = 25,0 g = 25,0 x 10-3 kg
Erstatning du har:
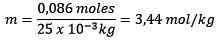
Eksempel 2
Problem: Hva er moralen i en løsning hvis 124,2 gram naoh oppløses i 1,00 liter vann? (Vanntetthet er lik 1,00 g/ml).
Svar: Vann er kjent som universell løsningsmiddel og tetthet er vanligvis gitt omtrent 1,00 gram per milliliter, eller hva som er det samme, 1 kilo per liter. Dette letter konverteringen fra liter til kilo.
I dette problemet vil de 124,2 gram NaOH måtte omdannes til føflekker (for mol av oppløst.
For det første er det Naohs molmasse:
P.mNa= 22,99 g/mol
P.mENTEN= 16 g/mol
P.mH= 1g/mol
P.mNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
For det andre konverteres Naohs gram til føflekker ved å bruke den molære deigen:
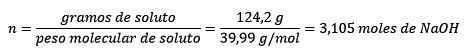
For det tredje blir liter av vann kilo ved bruk av tetthet:
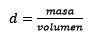
Rydde deigen, gjenstår:
Kan tjene deg: Gulloksid (iii) (AU2O3): Hva er, struktur, egenskaper, bruk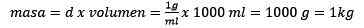
Endelig løses molelismens ligning:
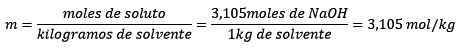
Eksempel 3
Problem: Hva er vannmassen til en vandig løsning som inneholder 0,52 gram bariumklorid (BACL2, PM = 208,23 g/mol) hvis konsentrasjon er 0,005 mol/kg?
Svar: I dette tilfellet brukes den moralske konsentrasjonen for å bestemme mengden vann i løsning.
Først oppnås antall mol BACL2 I løsningen:
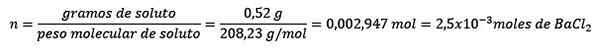
For det andre blir kiloene med løsningsmiddel ryddet fra molelismelikningen og løst.
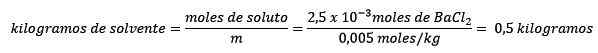
Referanser
- Beregning av molalitetseksempel Problem. Gjenopprettet fra Sciententes.org.
- Hva er et eksempel på molalitet? Gjenopprettet fra sokratisk.org.
- (S.F.). Moral. Utvunnet fra grenseløs.com.

