Kaliumnitritt (KNO2) struktur, egenskaper og bruk

- 2334
- 65
- Marius Aasen
Han Kaliumnitritt Det er et uorganisk salt hvis kjemiske formel er som2, som er kjemisk og farmakologisk relatert til kaliumnitrat3. Hans fysiske utseende består av gulaktige hvite krystaller, svært hygroskopiske, og derfor av deler; det vil si at de oppløses raskt i fuktige miljøer.
Formelen indikerer at andelen k -ioner+ og ikke2- Det er 1: 1, og forblir forent av elektrostatiske krefter eller av ioniske koblinger. Rene naturlige kilder har tilsynelatende ikke funnet for sine krystaller, selv om niteranioner kan finnes i jordsmonn, gjødsel, planter og dyr.
 Kaliumnitalkrystaller. Kilde: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Kaliumnitalkrystaller. Kilde: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Det øvre bildet viser hvordan Knos krystaller ser ut2, Med uttalte gule toner. Hvis disse krystallene blir stående i kontakt med luften, vil de absorbere fuktighet for å bli en vandig løsning; løsning som har generert kontroverser med hensyn til om bruken er gunstig eller ikke eller ikke.
På den annen side brukes krystaller, under veldig små mengder (200 ppm), til å salinisere kjøtt og garantere deres bevaring mot bakteriell handling. Også KNO2 Forbedrer fargen på kjøtt, og gjør dem mer rødlige; Imidlertid er det underlagt flere begrensninger for å unngå de giftige effektene av dette saltet på kroppen.
[TOC]
Kaliumnitrittstruktur
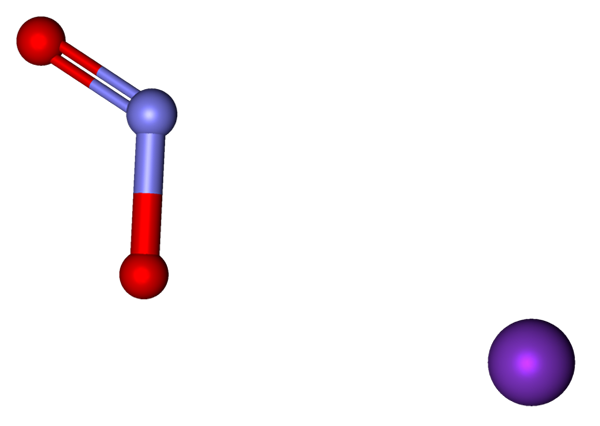 Ioner som utgjør KNO2 representert med en modell av kuler og barer. Kilde: Marinavladivok [CC0].
Ioner som utgjør KNO2 representert med en modell av kuler og barer. Kilde: Marinavladivok [CC0]. Ionene som er til stede i kaliumnitritt er vist ovenfor. Kationen k+ tilsvarer den lilla sfæren, mens anionen ikke gjør det2- Det er representert av de blålige og røde sfærene.
Anion nr2- Det vises med en dobbeltbinding og en enkel [o = n-o]-; Men i virkeligheten er begge koblingene de samme som et resultat av resonansen til den negative belastningen mellom dem.
K -ionene+ og ikke2- De tiltrekker hverandre i verdensrommet for å organisere et strukturelt mønster med minst energi; Dette er, der frastøttene mellom like belastninger er minimale. Og så tror KNO -krystaller2, hvis enhetscelle er utsatt for temperaturendringer, hvilke faseoverganger.
Kan tjene deg: Stanislao CannizzaroFor eksempel ved lave temperaturer (mindre enn 25 ° C) KNO -krystaller2 Vedta et monoklinisk system (fase I). Når temperaturen overstiger 25 ° C, oppstår en romboébisk monoklinisk faseovergang (fase II). Til slutt, over 40 ° C KNO -krystaller2 Endre å være kubikk (fase III).
Også KNO2 kan utvise andre krystallinske faser (faser IV, V og VI) under høyt trykk. Med dette, k ioner+ og ikke2- De ender opp med å bevege seg og bestilte på forskjellige måter i sine rene krystaller.
Egenskaper
Molekylmasse
85.1038 g/mol.
Tetthet
1 9150 g/ml.
Smeltepunkt
440,02 ° C (men begynner å bryte ned fra 350 ° C, og avgir giftige røyk).
Kokepunkt
537 ° C (eksplosjon).
Vannløselighet
312 g/ 100 g vann ved 25 ° C.
Avdelinger
Dens løselighet i vann er slik at det er hygroskopisk; Så mye, som viser delikans, absorberer tilstrekkelig fuktighet til å oppløse. Denne affiniteten til vann kan skyldes energistabiliteten som K -ioner får+ Når du hydrer, samt en lav krystallinsk nettverk entalpi for KNO -krystaller2.
Krystaller kan absorbere vann uten å løse opp for å bli hydrat2· H2ENTEN. I hydrat følger vannmolekylet med ionene, som endrer den krystallinske strukturen.
Dette hydratet (eller flere av dem) kan dannes under -9 ° C; Ved høyere temperatur løses vann opp og hydrerer ionene, og deformerer glasset.
Løselighet i andre løsningsmidler
Litt løselig i varme alkoholer, og veldig løselig i ammoniakk.
Ph
6-9. Dets vandige oppløsninger er derfor alkalisk, siden anionen ikke gjør det2- Det kan hydrolysisere.
Nomenklatur
Å kno2 Det kan også navngis på andre måter. 'Kaliumnitritt' tilsvarer navnet for dette saltet i henhold til bestandsnomenklaturen; 'Kaliumnitrito', i henhold til den systematiske nomenklaturen, der den eneste valensen av kalium, +1 blir fremhevet; og dioxonitrat (iii) av kalium, i henhold til den systematiske nomenklaturen.
Det kan tjene deg: Dibenzalacetona: egenskaper, reaksjonsmekanisme, bruksområder, risikoKalium 'dioxonitrat (III), fremhever valensen +3 av nitrogenatom. Selv navnet som er mest anbefalt av IUPAC for KNO2, 'Kaliumnitritt' fortsetter å være den mest behagelige og den enkleste å huske.
Å skaffe
Den mest direkte måten å syntetisere den på, men med lavere ytelse, er gjennom termisk nedbrytning av kaliumnitrat eller saltpeter ved 400 ° C eller mer:
2kno3 => Kno2 + ENTEN2
Imidlertid en del av KNO2 ender opp med å dekomponere med varme, i tillegg til andre produkter.
En annen metode for å forberede eller syntetisere den med høyere ytelse er ved å redusere KNO3 I nærvær av bly, kobber eller sink. Ligningen for denne reaksjonen er som følger:
Kno3 + PB => Kno2 + PBO
Kalium og blynitrat er blandet støkiometrisk i en jernpanne, hvor de smelter sammen med konstant omrøring og oppvarming i en halv time. Blyoksid (II) er gult, og den resulterende deigen er varm og behandlet med kokende vann. Så filtrerer den varme blandingen.
Det varme filteret bobler med karbondioksid i fem minutter, noe som vil utfelle karbonat, PBCO3, uoppløselig. På denne måten er blyledningen ferdig. Salpetersyre fortynnet til filtreringen tilsettes til pH er nøytral, den er lov til å avkjøle, og til slutt fordamper vannet slik at krystallene til KNO blir dannet2.
applikasjoner
Tilsetningsstoff og reagens
Kaliumnitritt brukes som tilsetningsstoff for å kurere rødt kjøtt, opprettholde deres smak og mer tidsfarge under lagring, mens forsinker bakteriell handling og visse giftstoffer, for eksempel botulinikk. Derfor viser den antibakteriell handling.
Kno2 Den oksiderer ikke, noe som reagerer med myoglobin av kjøttet og ender følgelig opp med å endre den naturlige røde fargen. Når kjøttet er kokt, skaffer det seg sin karakteristiske sterk rosa farge.
Kan tjene deg: 20 eksempler på kjemisk sublimering og egenskaperImidlertid under forhold uten å spesifisere KNO2 reagerer med kjøttproteiner for å gi opphav til nitrosamin, som kan bli kreftfremkallende.
På den annen side, Kno2 (Selv om det helst nano2) Det er et analytisk reagens som kan brukes i syntesen av azoiske fargestoffer (reaksjonen av lystsyre med aromatiske aminer), og i aminosyreanalysen.
Motgift
Mens det har sine negative effekter, kno2 Det fungerer som en motgift hos forgiftede pasienter med cyanider og hydrogensulfid. Mekanismen er å oksidere trossentrene2+ til tro3+ Av gruppene vi har av hemoglobinene, produserer metemoglobin, som deretter reagerer med CN -anionene- og HS-.
Leger
I magesaften i magen gjør ikke anionen2- Det reduseres til ikke, som er kjent for å ha vasodilatorhandling, og øker blodstrømmen. I andre regioner av kroppen der pH ikke er nok syre, er noen enzymer, for eksempel oksidert xanthina, ansvarlige for å redusere ikke -2-.
Kno har blitt brukt2 å behandle plager og sykdommer som brystangina og epilepsi (med veldig negative bivirkninger).
Referanser
- Wikipedia. (2019). Kaliumnitritt. Hentet fra: i.Wikipedia.org
- Prebchem. (2016). Forberedelse Kaliumnitritt. Gjenopprettet fra: Prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Uorganisk nitrat og nitritt og kontroll av blodtrykk, kardiovaskulær forskning, bind 89, utgave 3, 15 februber 2011, side 492-498, doi.org/10.1093/CVR/CVQ309
- Pubchem. (2019). Kaliumnitritt. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Kjemisk formulering. (2018). Kaliumnitritt. Gjenopprettet fra: Quimica -formulering.com
- Nasjonalt senter for å fremme translasjonsvitenskap. (2011). Kaliumnitritt. Gjenopprettet fra: narkotika.ncats.Io
- Richard J. Eley, Paul B. Addis, og Joseph J. WARTHEEN. (1992). Nitritt i kjøtt. University of Minnesota.
- N. R. Rao, f. Prakash, og m. Natarajan. (1975). Krystallstrukturtransformasjoner i uorganiske nitritter, nitrater og karbonater. Department of Chemistry, Indian Institute of Technology, Kanpur, India.
- « Politiske taleegenskaper, typer, spørsmål og eksempler
- Søppelforurensningsårsaker, konsekvenser og eksempler »

