Nukleofil nukleofilt angrep, typer, eksempler, nukleofilisitet
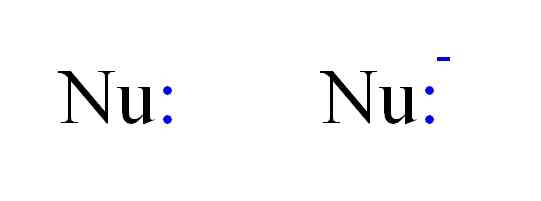
- 3645
- 749
- Anders Mathisen
EN nukleofil Det er alt atom, ion eller molekyl som søker å donere par elektroner til stoffer med positiv belastning eller regioner. Ordet betyr 'kjærlighet til kjernene'. Når et atom eller et molekylært område er dårlig i elektroner, opplever det en kraft med større tiltrekning av atomkjernene; Og nettopp, denne attraksjonen tiltrekker nukleofiler.
Derfor, ettersom motsatte tegnladninger tiltrekkes, må nukleofiler være negative arter; eller i det minste, ha svært negative regioner på grunn av en lokal eller spredt elektronkonsentrasjon.
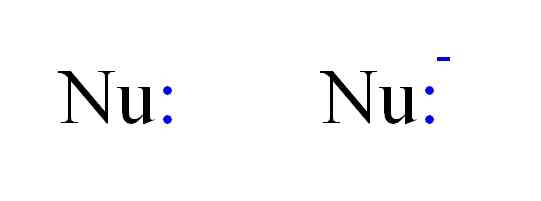 De to hyppigste typene nukleofiler i kjemi. Kilde: Gabriel Bolívar.
De to hyppigste typene nukleofiler i kjemi. Kilde: Gabriel Bolívar. Dermed kan en nukleofil være representert med NU -bokstavene, som på bildet over. De doble punktene i blått tilsvarer et par elektroner, som donerer til elektrofilen; Dette er atomet eller dårlig elektronmolekyl. Merk at nukleofilen kan være nøytral eller anionisk, men begge donerer elektronpar.
Angrepet av nukleofiler til elektrofiler er hjørnesteinen i utallige reaksjoner og organiske mekanismer. Et eksempel på nukleofil er hydroksylanion, OH-, som også oppfører seg som en base. Imidlertid bør nukleofilisitet aldri forveksles med grunniteten til et stoff.
[TOC]
Nukleofilt angrep
Nukleofiler ser ut. Følgende kjemiske ligning representerer nukleofilangrepet:
Wildebeest: + R-LG → R-NU + LG:
Nukleofilen Nu: Donerer dets elektroner A R, som er knyttet til en elektronegativ LG -gruppe. Ved å gjøre dette er R-LG-lenken ødelagt, LGs Emigra :, og den nye R-NU-lenken er dannet. Dette er grunnlaget for mange organiske reaksjoner.
Det vil sees i neste avsnitt at en nukleofil til og med kan være en aromatisk ring, hvis elektroniske tetthet er spredt i sentrum. På samme måte kan en nukleofil bli en sigma -binding, noe som betyr at elektronene med samme emigrater eller hopper inn i kjerner i nærheten.
Kan tjene deg: Kaliumkromat (K2CRO4)Typer nukleofiler
Det er flere typer nukleofiler, men den enorme majoren.
Arter med gratis elektronpar
Når vi snakker om arter med frie elektronpar, refererer vi til anioner, eller molekyler med elektronegative atomer, for eksempel oksygen, nitrogen og svovel. I eksempleseksjonen vil mange nukleofiler av denne typen sees, bortsett fra anion oh- allerede nevnt.
Dobbeltkoblinger
En nukleofil kan ha dobbeltbindinger, som er ansvarlige for det nukleofile angrepet. Imidlertid må de være dobbeltbindinger med en betydelig elektronisk tetthet, så ikke noe molekyl som besitter dem vil bli betraktet som en sterk nukleofil; det vil si at det ikke vil ha en høy nukleofilisitet.
Tenk for eksempel på benzenringen i følgende reaksjon av alkylering (Friedel-Crafts-reaksjon):
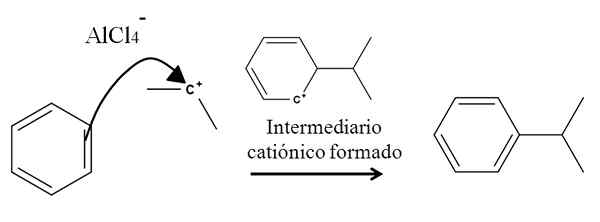 Benzenalkylering i aromatisk elektrofil substitusjon. Kilde: Gabriel Bolívar.
Benzenalkylering i aromatisk elektrofil substitusjon. Kilde: Gabriel Bolívar. Tilstedeværelsen av en ALCL -blanding3-(Ch3)2CHCl har sin opprinnelse isopropylkarbokasjon. Den positive belastningen og ustabiliteten tiltrekker sterkt elektronene til en av dobbeltbindingene til benzenet, som angriper karbokasjon, som representert av pilen.
I prosessen dannes en kort kationisk og aromatisk intermadiary, som endelig blir omgjort til riktig produkt.
I tillegg til benzen kan andre stoffer med dobbeltbindinger fungere som nukleofiler, forutsatt at reaksjonsbetingelsene er de mest passende. På samme måte må det være atomer som ligger i nærheten av dobbeltbindingen som donerer elektronisk tetthet, slik at de "lades ut" av elektroner.
Sigmas lenker
Sigma -bindinger som sådan er ikke nukleofiler; Men det kan oppføre seg som sådan når en reaksjon begynner og mekanismen begynner. Tenk på følgende eksempel:
Det kan tjene deg: Linding Salter: Hva er, nomenklatur, egenskaper, eksempler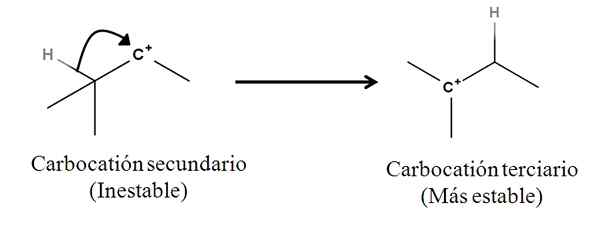 Konvertering av en sekundær til tertiær karbokasjon ved migrasjon fra en hydridanion. Kilde: Gabriel Bolívar.
Konvertering av en sekundær til tertiær karbokasjon ved migrasjon fra en hydridanion. Kilde: Gabriel Bolívar. Sigma C-H-bindingen ved siden av Carbocation beveger seg mot ham som oppfører seg som en nukleofil (se bevegelse av den buede pilen). I denne forstand er resultatet at anion h beveger seg- til det nærliggende karbon, men så raskt at Sigma -bindingen og dets par av elektroner som det nukleofile middelet til denne mekanismen blir vurdert.
Nukleofile eksempler
Denne delen vil nevne flere eksempler på den første typen nukleofiler, som er veldig rikelig og viktig i organisk og uorganisk kjemi.
Halogenuros
Halogenuros (f-, Cl-, Br- og jeg-) De er nukleofiler. Må donere et av sine fire par valenselektroner. Avhengig av hastigheten som en av disse halogenuros angriper elektrofi, vil ha større eller mindre nukleofilisitet.
Generelt sett I- Det er bedre nukleofil enn f- og de andre halogenuros, siden det er lettere å danne en kovalent kobling fordi den er mer polariserbar; Det vil si mer klumpete og med mindre iherdighet til å gi fra seg paret med elektroner.
Elektronegative atommolekyler
 Vannmolekyler
Vannmolekyler Vann, hah, er en nukleofil, fordi oksygenatom har høy negativ tetthet og frie elektronpar for å donere og danne en kovalent binding. Også alkoholer, ROH, er nukleofiler, av samme grunner som vann.
Små nitrogenmolekyler som ammoniakk, NH3, De har også en tendens til å være nukleofiler. Dette er fordi nitrogen kan donere sitt ensomme par elektroner. Tilsvarende aminer, RNH2, De er også nukleofiler.
Og i tillegg til små molekyler med oksygen eller nitrogen, teller også svulfurer som nukleofiler. Dette er tilfellet med hydrogensulfid, h2S, og Thioles, Rsh.
Svovel er bedre nukleofil enn oksygen og nitrogen fordi det er mindre "klamrer". Til dette faktum må også legges til at atom.
Det kan tjene deg: MOHR -metode: grunnleggende, reaksjoner, prosedyre, brukAnioner
Oksygenert, nitrogen, sulfuriserte anioner, og generelt er flere av dem sterke nukleofiler. Dette er fordi de nå har en negativ belastning som ytterligere forsterker tilstedeværelsen av elektronparet de vil donere.
Tenk for eksempel følgende anioner plassert i synkende rekkefølge av nukleofilisitet:
: Kap3- >: NH2- >: Å- >: F-
Carboanion Ch3- Det er den sterkeste nukleofilen fordi karbonatomet ikke stabiliserer den negative belastningen, hvis elektroner er "desperate" med nærliggende kjerner. Dette skjer ikke med Amiduro, NH2-, hvis nitrogenatom bedre stabiliserer den negative belastningen og gir lettere elektroner enn OH- eller f-.
Nukleofilisitet
Nukleofilisitet definerer hvor sterk nukleofilkarakteren til en art er. Dette avhenger av mange faktorer, men det viktigste er det steriske hinderet under det nukleofile angrepet og virkningen av løsningsmidlet.
Jo mindre nukleofil, jo raskere og effektive vil det være ditt elektrofile angrep. Også hvor mye lavere interaksjonene mellom løsningsmidlet og nukleofilen. Derfor, i henhold til dette, jeg- har større nukleofilisitet enn f-.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- James Ashenhurst. (2020). De tre klassene av nukleofiler. Gjenopprettet fra: MasterorganicChemistry.com
- Professor Patricia Shaley. (2012). Nukleofiler og elektrofiler. University of Illinois. Gjenopprettet fra: Butan.Chem.Uiuc.Edu
- Wikipedia. (2020). Nukleofil. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11. februar 2020). Nukleofil definisjon i kjemi. Gjenopprettet fra: Thoughtco.com
- Rachael Curtis. (5. juni 2019). Nukleofil. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Termodynamiske systemegenskaper, typer, eksempler
- Equisient Narrator -konsept, egenskaper og eksempler »

