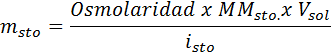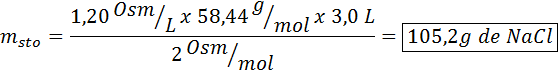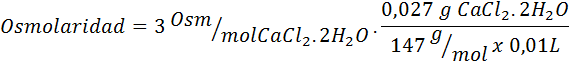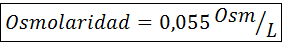Osmolaritet
- 1582
- 21
- Prof. Theodor Gran
Hva er osmolaritet?
De Osmolaritet Det er en konsentrasjonsenhet som indikerer den molare konsentrasjonen av settet med osmotisk aktive partikler som er til stede i en løsning. Med andre ord, osmolaritet er molariteten til osmotisk aktive partikler.
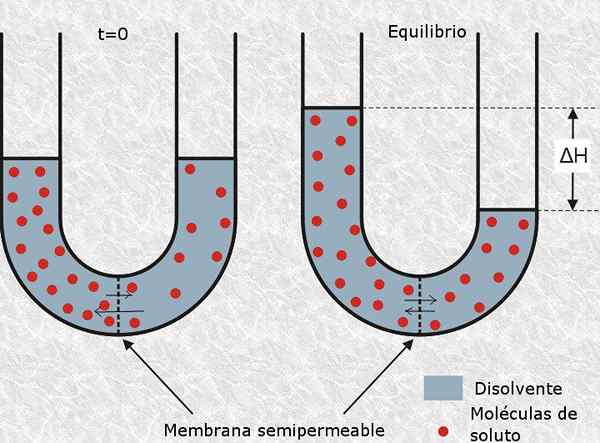
er definert som Osmotisk aktiv partikkel til det nøytrale eller ionemolekylet som ikke kan krysse en semipermeabel membran, for eksempel cellemembranen. Tilstedeværelsen av denne typen partikler genererer osmotisk trykk i løsningen, og derav navnet.
Antall mol med osmotisk aktive partikler kalles Osmoles (representert av OSM -symbolet), så osmolaritet kommer til uttrykk i enheter av OSM/L.
Viktigheten av osmolaritet
Osmolaritet er et begrep av stor betydning for biologi og medisin, siden den osmotiske balansen i celler med miljøet er avgjørende for å overleve. For eksempel å injisere en løsning med en veldig høy eller veldig lav osmolaritet intravenøst, kan lett forårsake død for en pasient.
 Osmolaritet er et essensielt aspekt av løsninger innen medisin og biologi
Osmolaritet er et essensielt aspekt av løsninger innen medisin og biologi På den annen side er en veldig vanlig teknikk som cellebiologer bruker for å bryte celler av forskjellige typer gjennom osmotisk lysis. Dette består av å plassere cellene i en hypotonoppløsning (med en veldig lav osmolaritet) slik at vannet i løsningen trenger inn i osmose og sprenger dem.
Dette gjør det veldig viktig, både for leger og for biologer og fagpersoner fra andre områder, å vite, måle eller vite hvordan de skal beregne osmolariteten til en løsning.
Kan tjene deg: prosentvis konsentrasjonForskjeller mellom osmolaritet og osmolalitet
Når du snakker om osmolaritet, er det også nødvendig å snakke om osmolalitet. Osmolalitet ligner osmolaritet, på samme måte som moral ligner på molaritet.
Mens osmolaritet indikerer Antall osmoler per liter løsning (OSM/L), Osmolalitet indikerer det samme, men For hvert kilo løsningsmiddel (OSM/kg).
Osmolalitet har fordelen at det ikke, avhengig av volumet på løsningen, og heller ikke avhenger av tettheten eller temperaturen. Av denne grunn vil en løsning ha samme osmolalitet ved 25 ° C som ved 37 ° C. På den annen side vil dens 37 ° C osmolaritet være litt lavere enn dens osmolaritet ved 25 ° C, på grunn av økningen i termisk ekspansjonsvolum.
Osmolaralitet er vanligvis lettere å måle eksperimentelt enn osmolaritet. Imidlertid er osmolaritet lettere å beregne og er en enklere enhet å jobbe når fortynninger blir utarbeidet.
Hvordan beregnes osmolariteten til en løsning?
Det er flere måter å beregne osmolariteten til en løsning, avhengig av informasjonen som telles. Det kan beregnes fra:
- Mengdene av løst og løsning.
- Molariteten til de tilstedeværende oppløste stoffer.
- Individuelle ionekonsentrasjoner.
- Prosentandelen M/V av oppløste stoffer, blant andre.
I alle tilfeller er beregningen basert på den generelle formelen for osmolaritet, som er:

Hvor nOSM Det er antall osmol som er til stede i løsningen og Vsol Det er volumet av det samme uttrykt i liter. Antall osmoles beregnes ved å multiplisere antall føflekker i løsten med antall partikler der det dissosierer i løsning.
Kan tjene deg: heterogene blandinger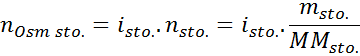
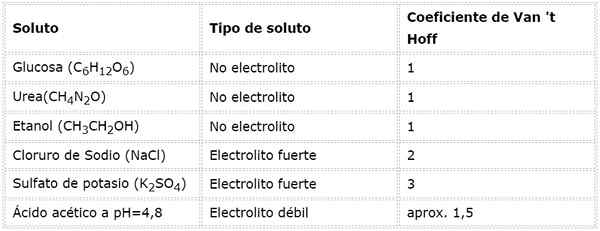
I denne ligningen, nsto Det er antall mol oppløst, msto er dens masse (i g), Mmsto Det er dens molmasse (i g/mol) og Yosto Det er koeffisienten til van 't hoff av oppløsningen. Denne koeffisienten har en verdi av 1 for ikke -elektrolytter oppløste stoffer (Som glukose, for eksempel).
For sterke elektrolytter som er fullstendig dissosiert (for eksempel natriumklorid, NaCl) er Van 'T hoff -koeffisienten lik det totale antall ioner der hver mol av forbindelsen dissosierer.
For eksempel i tilfelle av kaliumsulfat, k2SW4, hvis dissosiasjonsreaksjon er:
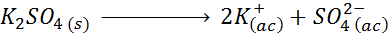
Hver mol av saltet som oppløses produserer 3 mol ioner (2 K -ioner+ Og 1 så ion42-), derav I = n = 3.
Når det gjelder svake elektrolytter, er beregningen mer komplisert, men de blir vanligvis bestemt eksperimentelt. Følgende tabell oppsummerer koeffisientene til Van 'T Hoff for noen vanlige oppløste stoffer.
Eksempler på osmolaritetsberegning
1. Eksempel 1
Bestem osmolariteten til en forberedt løsning ved å løse opp 10 g NaCl og 10 g glukose i 100 ml løsning
Løsning: I dette tilfellet beregnes osmolene til hvert oppløst stoff separat og legger deretter til. Molmassene er henholdsvis 58,45 g/mol og 180 g/mol, og ve -t hoff -koeffisientene er 2 og 1:
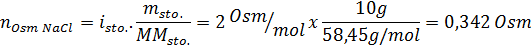
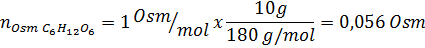
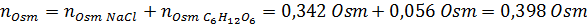
Nå beregner vi osmolariteten ved å bruke formelen, vel vitende om at 100 ml tilsvarer 0,100L:
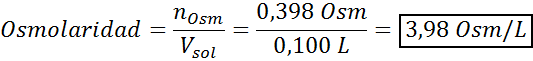
Endelig er osmolariteten til løsningen 3,98 OSM/L.
2. Eksempel 2
Bestem osmolariteten til en 0,05 løsnings kaliumsulfat molar.
Løsning: Hvis vi allerede kjenner molariteten til oppløsningen, er beregning av osmolariteten så enkel som å multiplisere denne konsentrasjonen med van 't hoff -faktoren.
Kan tjene deg: benzaldehyd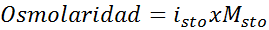
I dette tilfellet er saltfaktoren 3.
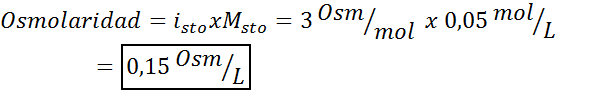
3. Eksempel 3
Bestem osmolariteten til en plasmaprøve som inneholder 0,125 M natriumioner, 0,020 M kaliumioner og 0,145 kloridioner.
Løsning: Osmolariteten til de enkelte ioner er lik deres molaritet, siden ionene ikke dissosierer mer og har en I = 1. Av denne grunn er det i dette tilfellet bare nødvendig å multiplisere med I = 1 Hver konsentrasjon og tilsett:
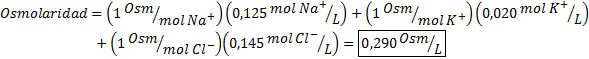
4. Eksempel 4
Beregn osmolariteten til en løsning som inneholder 27 mg cap2.2H2Eller for hver 10 ml løsning
Løsning: Cochl molekylvekt2.2H2Eller det er 147 g/mol. Når det oppløses, blir dette saltet separert i 2 vannmolekyler og tre ioner. Vannmolekyler er imidlertid ikke osmotisk aktive partikler, så de blir ikke tatt med i betraktningen for beregningen av osmolaritet, og koeffisienten for denne forbindelsen er 3.

5. Eksempel 5
Hvilken masse natriumklorid er nødvendig for å fremstille 3 liter av en løsning hvis osmolaritet er 1,20 OSM/L?
Løsning: I dette tilfellet, ettersom massen av oppløsning blir bedt om og vi har volum og konsentrasjon, er det nok til å fjerne massen av osmolaritetsformelen.