Natriumoksalat (Na2C2O4) struktur, egenskaper, bruksområder, risikoer

- 2321
- 408
- Prof. Theodor Gran
Han natriumoksalat Det er en organisk forbindelse dannet av to natriumioner og et oksalation. Den kjemiske formelen er NA2C2ENTEN4 eller også na2(COO)2. Det er natriumsalt av oksalsyre eller etanodiosyre. Deretter en2C2ENTEN4 Det er et krystallinsk hvitt faststoff og dets vandige oppløsninger er grunnleggende (alkalisk).
Natriumoksalat er til stede i planter og grønnsaker. Hos mennesket genereres det naturlig fra dens konjugerte syre oksalsyre, som igjen produseres av visse metabolske prosesser.
 Natriumoksalat Na2(COO)2 fast. Lem [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Natriumoksalat Na2(COO)2 fast. Lem [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Deretter en2C2ENTEN4 Det brukes i kjemiske analyselaboratorier som et reduksjonsmiddel (det motsatte av oksidant). Også for å tillate tester til visse organiske forbindelser under avløpsvannbehandling.
Det har blitt brukt til eliminering av klorofluorokarboner avfall (CGC), som skader ozonlaget. Det er også råstoff å oppnå oksalsyre på en økonomisk måte.
På grunn av det høye natriumoksalatinnholdet i noen spiselige grønnsaker, bør personer som har en tendens til å danne beregninger eller nyrestein unngå å konsumere slik mat. Dette er fordi steinene generelt er dannet med oksalater.
[TOC]
Struktur
Natriumoksalat består av to natriumna -kationer+ og en oksalatanion (COO)22-. Oksalatanion dannes etter tur av to COO- sammen med de to karbonatomene: -Ooc-coo-.
I fast natriumoksalat har oksalatanion en flat form. Dette betyr at både karbon og oksygen finnes i samme plan.
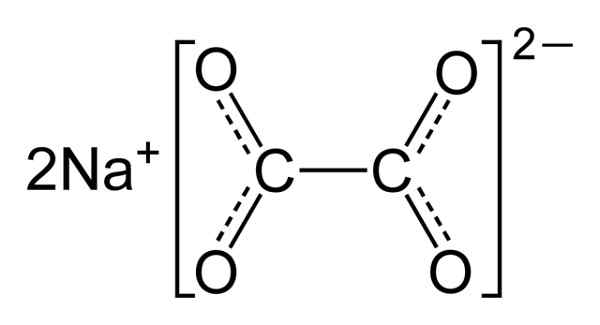 Kjemisk struktur av natriumoksalat2(COO)2. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Kjemisk struktur av natriumoksalat2(COO)2. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Nomenklatur
- Natriumoksalat
- Dysodio oksalat
- Natriumsalt av etanodiosyre
Egenskaper
Fysisk tilstand
Krystallinsk hvitt fast stoff.
Molekylær vekt
134,0 g/mol
Tetthet
2,27 g/cm3 ved 20 ° C.
Løselighet
Vannløselig: 3,7 g/100 ml ved 20 ° C.
Ph
Dens vandige oppløsninger er basiske (alkalisk) fordi oksalatanionen har en tendens til å ta vannprotoner som forlater ionene oh free-.
Kan tjene deg: neon: historie, egenskaper, struktur, risiko, brukKjemiske egenskaper
Det kan nøytralisere syrer og reaksjoner er eksotermiske, det vil si at de gir fra seg varme.
Det fungerer som et reduserende middel, og i disse reaksjonene genererer det karbondioksid CO2.
Det har eiendommen til å gå sammen med flere metallioner som jernioner tro2+ og jernholdig tro3+.
Å skaffe
I følge en konsultert kilde, kan natriumoksalat oppnås oksiderende oksygen eller2 Ved en temperatur på omtrent 250 ° C i en konsentrert løsning av NaOH -natriumhydroksyd.
Tilstedeværelse i naturen
Natriumoksalat er til stede i mange planter og grønnsaker, som chard, spinat og ruibarbo, og i korn som soyabønner, blant mange andre planteprodukter.
 Spinat har mye natriumoksalat. Forfatter: Aline Ponce. Kilde: Pixabay.
Spinat har mye natriumoksalat. Forfatter: Aline Ponce. Kilde: Pixabay. Den konjugerte syre oksalsyre oppstår i den menneskelige organismen ved metabolisme av glykolsyre eller askorbinsyre. Når den er produsert, er den ikke metabolisert, men skilles ut av oksalat -formet urin.
 Ruibarbo inneholder natriumoksalat. Forfattere: s. Hermann & F. Richter. Kilde: Pixabay.
Ruibarbo inneholder natriumoksalat. Forfattere: s. Hermann & F. Richter. Kilde: Pixabay. applikasjoner
I kjemiske analyselaboratorier
Det brukes som et kjemisk reagens, vanligvis som et reduksjonsmiddel, for eksempel for standardisering av kaliumpermanganatløsninger, det vil si for å bestemme nøyaktig hvor mye natriumpermanganat de har.
I ødeleggelsen av klorfluorokarboner
Natriumoksalat har blitt brukt til ødeleggelse av klorfluorokarboner (CFC). Disse CFC -forbindelsene har vært en av de ansvarlige for ødeleggelsen av planetens ozonlag (som beskytter oss mot ultrafiolett stråling).
I 1996 foreslo noen forskere bruk av natriumoksalat for å eliminere dem, da det lett reagerer med CFC ved temperaturer på 270-290 ° C, noe som gjorde dem ufarlige produkter mot ozonlaget.
Natriumoksalatreaksjon med CFC kan kontrolleres for å oppnå halogenerte aromatiske hydrokarboner som ikke er skadelige for ozonlaget, men som er nyttige forbindelser i den kjemiske industrien.
Det kan tjene deg: Propylenglykol: Struktur, egenskaper, syntese og brukDenne reaksjonen kan også bringes maksimalt og konvertere hele CFC til NAF -natriumfluorid, Soll -natriumklorid, elementært karbon og karbondioksid CO2.
 Planetens ozonlag beskytter oss mot solens ultrafiolette stråler. Natriumoksalat lar deg eliminere CFC -forbindelsene som skader det. Forfatter: One94. Kilde: Pixabay.
Planetens ozonlag beskytter oss mot solens ultrafiolette stråler. Natriumoksalat lar deg eliminere CFC -forbindelsene som skader det. Forfatter: One94. Kilde: Pixabay. Ved å bestemme viktige parametere i avløpsvannbehandling
Det har blitt funnet at natriumoksalat er nyttig for å måle mengden og klasser av organiske forbindelser som utskiller slammikroorganismer som brukes til å behandle avløpsvann.
Målet på slike forbindelser er viktig for å bestemme deres funksjon under behandlingen av avløpsvann, siden det enkle å skille gjørmen fra vannet avhenger av dem.
Ved bruk av natriumoksalat unngås ulempene med andre metoder.
For å oppnå oksalsyre
Rå natriumoksalat fra avfall fra visse prosesser har blitt brukt til å produsere oksalsyre H2C2ENTEN4 i store mengder.
Metoden bruker slam fra Bayer -prosessen for å behandle bauxitt (et aluminiumsmineral). I Bayer -prosessen behandles bauxitt med NaOH -natriumhydroksyd for å oppløse aluminiumoksyden i dette mineralet.
I prosessen med å oppløse aluminiumoksyd blir visse organiske forbindelser som er til stede i mineralet slik som huminsyrer angrepet av NaOH, og genererer en stor mengde natriumoksalat Na2C2ENTEN4.
Dette natriumoksalatet er inkorporert i en gjørme med aluminiumforbindelser. For å rense den, blir monteringen oppløst, den filtreres og føres gjennom en sur -type ionebytterkolonne.
I kolonnen er det en RSO sulfonsyreharpiks3H hvor na metalliske ioner byttes ut+ av hydrogenioner h+, Så du får oksalsyre H2C2ENTEN4.
Rso3H + Na2C2ENTEN4 ⇔ RSO3Na + nahc2ENTEN4
Kan tjene deg: Kaliumkarbonat (K2CO3): Struktur, egenskaper, bruksområder, innhentingRso3H + NAHC2ENTEN4 ⇔ RSO3Na + H2C2ENTEN4
Dette er en økonomisk prosess og den oppnådde oksalsyre er av akseptabel renhet.
For å fjerne uønskede forbindelser
Konjugert natriumoksalatsyre, oksalsyre H2C2ENTEN4, Det brukes til å løse opp visse typer avfall og inlays.
Oksalsyren som er karakteristisk for å bli oksalat brukes som et komplekst eller utfellende middel, for eksempel under prosessering av avfall fra forskjellige kjernefysiske drivstoff.
Oksalsyre brukes også til å fjerne innleggene av mineraler og jernoksider i rør og annet utstyr, dette skyldes den2+ som den jernholdige troen3+ danner oksalater.
Risiko
Hvis natriumoksalat inhaleres eller inntatt direkte. Det produserer oppkast, alvorlig rensing, svak puls, kardiovaskulær kollaps, nevromuskulære symptomer og nyreskade.
Personer som har en tendens til å danne beregninger i nyrene på grunn av akkumulering av oksalat i urinen, bør unngå å konsumere grønnsaker med et høyt innhold av oppløselige oksalater som natrium.
Natriumoksalat i høye mengder i maten når du når urin binder seg til kalsium som er til stede i dette og kan produsere beregninger eller steiner av kalsiumoksalat i nyrene til personer som har en tendens til å gjøre det.
 Natriumoksalat av noen matvarer kan føre til dannelse av steiner i nyrene til personer med disponering for det. Forfatter: Azwer. Kilde: Pixabay.
Natriumoksalat av noen matvarer kan føre til dannelse av steiner i nyrene til personer med disponering for det. Forfatter: Azwer. Kilde: Pixabay. Referanser
- ELLER.S. National Library of Medicine. (2019). Natriumoksalat. Nasjonalt senter for bioteknologiinformasjon. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Chai, w. Og Liebman, m. (2005). Effekt av forskjellige koke metoder på vegetabilsk oksalatinnhold. J. Agric. Food Chem. 2005, 53, 3027-3030. Gjenopprettet fra puber.ACS.org.
- Dagani, r. (nitten nittiseks). CFC ødelegger Reion. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Gjenopprettet fra puber.ACS.org.
- SAJAD, m. og Kim, K.S. (2016). Ekstraksjon av ekstracellulære polymere stoffer fra aktivert slam ved bruk av natriumoksalat. Int. J. Miljø. Sci. TECHNOL. 13, 1697-1706 (2016). Lenke gjenopprettet.Springer.com.
- Jeffrey, g.TIL. Og parry, g.S. (1954). Krystallstrukturen til natriumoksalat. J. ER. Chem. Soc. 1954, 76, 21, 5283-5286. Gjenopprettet fra puber.ACS.org.
- Okuwaki, a. et al. (1984). Produksjon av oksalat ved oksidasjon av kull med oksygen i en konsentret natriumhydroksydoppløsning. Ind. Eng. Chem. Prod. Storfekjøtt. Dev. 1984, 23, 648-651. Gjenopprettet fra puber.ACS.org.
- Hefter, g. et al. (2018). Løselighet av natriumoksalat i konsentrerte elektrolyttløsninger. J Chem & Eng Data. 2018, 63, 3, 542-552. Gjenopprettet fra puber.ACS.org.
- La k. Yo. (1992). Prosess for fremstilling av oksalsyre og natriumhydrogenoksalat fra rå natriumoksalat. ELLER.S. Patent nr. 5.171.887. Des.15, 1992. Hentet fra FreePatentSSonline.com.
- « Happer historie, funksjoner, egenskaper, svar på inmunes
- Natrium tripoliphosphate (Na5p3O10) struktur, egenskaper, bruksområder, påvirkning »

