Oksygenegenskaper, struktur, risikoer, bruker

- 1965
- 19
- Markus Fredriksen
Han oksygen Det er et kjemisk element som er representert av symbolet eller. Det er en veldig reaktiv gass, som leder gruppe 16: Calcogenene. Dette navnet skyldes at svovel og oksygen er til stede i nesten alle mineraler.
Den høye elektronegativiteten forklarer sin store aviditet av elektroner, noe som fører til kombinert med et høyt antall elementer; Slik oppstår et bredt spekter av mineraloksider som beriker jordskorpen. Dermed komponerer de gjenværende oksygenet og gjør atmosfæren pustende.
 Oksygen er vanligvis synonymt med luft og vann, men det finnes også i steiner og mineraler. Kilde: Pxhere.
Oksygen er vanligvis synonymt med luft og vann, men det finnes også i steiner og mineraler. Kilde: Pxhere. Oksygen er det tredje elementet i overflod i universet, bak hydrogen og helium, og er også hovedmassekonstituenten til jordens cortex. Den har en volumprosent på 20,8% av jordens atmosfære, og representerer 89% av vannmassen.
Den har vanligvis to allotropiske former: diatomisk oksygen (eller2), som er den hyppigste måten i naturen, og ozon (eller3), funnet i stratosfæren. Imidlertid er det to andre (eller4 Jeg8) som finnes i flytende eller faste faser, og under stort trykk.
Oksygen produseres kontinuerlig gjennom fotosynteseprosessen, utført av planteplankton og terrestriske planter. Når den er produsert, blir den utgitt slik at levende vesener kan bruke den, mens en liten del av den løses opp i havene, og støtter vannlevende liv.
Det er derfor et essensielt element for levende vesener; Ikke bare fordi det er til stede i de fleste forbindelser og molekyler som danner dem, men også griper inn i alle metabolske prosesser.
Selv om den kontroversielt isolasjonen tilskrives Carl Scheele og Joseph Priestley i 1774, er det indikasjoner på at oksygen faktisk ble isolert for første gang i 1608, av Michael Sendivogius.
Denne gassen brukes i medisinsk praksis for å forbedre levekårene til pasienter med luftveisvansker. På samme måte brukes oksygen for å tillate folk å oppfylle sine funksjoner i miljøer der det er redusert eller ingen tilgang til atmosfærisk oksygen.
Kommersielt produsert oksygen brukes hovedsakelig i metallurgisk industri for jernkonvertering til stål.
[TOC]
Historie
Nitroarial ånd
I 1500, Leonardo da Vinci, basert på eksperimentene til Philo de Byzantium holdt i det andre århundre til. C., Han konkluderte med at en del av luften ble konsumert under forbrenning og pust.
I 1608 viste Cornelius Drebble at varmerommet (sølvnitrat, KNO3) En gass oppsto. Denne gassen, som den ville bli kjent senere, var oksygen; Men Drebble kunne ikke identifisere det som et nytt element.
Deretter, i 1668, påpekte John Majow at en del av luften han kalte "Spiritus Nitroaerus" var ansvarlig for brann, og at den også ble konsumert under pusting og forbrenning av stoffer. Majow observerte at stoffer ikke ordnet i fravær av nitroarial ånd.
Majoow utførte antimonforbrenningen, og observerte en økning i vekten av antimon under hans forbrenning. Da konkluderte Majow med at antimon kombinert med nitroarial ånd.
Oppdagelse
Selv om han ikke fikk anerkjennelse fra det vitenskapelige samfunnet, i livet eller etter hans død, vil Michael Sandivogius (1604) sannsynligvis være den sanne oppdageren av oksygen.
Sandivogius var en alkymist, filosof og svensk lege som produserte den termiske nedbrytningen av kaliumnitrat. Hans eksperimenter førte ham til frigjøring av oksygen, som han kalte "Cibus Vitae": Livets mat.
Mellom 1771 og 1772 varmet den svenske kjemikeren Carl W Scheele flere forbindelser: kaliumnitrat, manganoksid og kvikksølvoksid. Scheele observerte at en gass som økte forbrenningen ble frigjort fra dem, og som han kalte "Fire Air".
Joseph Priestly eksperimenter
I 1774 varmet den engelske kjemikeren Joseph Priestly Mercury Oxide ved å bruke et tolv -tommers økningslinse som konsentrerte sollys. Kvikksølvoksid frigjorde en gass som fikk lyset til å brenne mye raskere enn normalt.
I tillegg testet prestisk den biologiske effekten av gass. For å gjøre dette plasserte han i en lukket beholder en mus som han forventet å overleve femten minutter; I nærvær av gass overlevde han imidlertid en time, mer enn han estimerte.
Prest publiserte resultatene sine i 1774; Mens Scheele gjorde det i 1775. Av denne grunn tilskrives oppdagelsen av oksygen til prest.
Oksygen i luften
Antoine Lavoisier, en fransk kjemiker (1777), oppdaget at luften inneholder 20% oksygen og at når et stoff brenner, kombinerer den faktisk med oksygen.
Lavoisier konkluderte med at den tilsynelatende vektøkningen som stoffer opplevde under forbrenning skyldtes vekttapet som oppstår i luften; Siden oksygen kombinert med disse stoffene og derfor ble massene av reaktantene bevart.
Dette tillot Lavoisier å etablere loven om bevaring av materie. Lavoisier foreslo navnet på oksygen som kom fra roten "Oxys" syre og "gener" -dannelse. Da betyr oksygen 'syre tidligere'.
Dette navnet er galt, siden ikke alle syrer inneholder oksygen; For eksempel hydrogenhalogenider (HF, HCl, HBR og HI).
Dalton (1810) tildelt vannet den kjemiske formelen Ho og derfor var atomvekten av oksygen 8. En gruppe kjemikalier, inkludert: Davy (1812) og Berzelius (1814) korrigerte Daltons tilnærming og konkluderte med at riktig formel for vannet er h2O og atomvekten av oksygen er 16.
Kan tjene deg: Forstyrrelser av vannFysiske og kjemiske egenskaper
Utseende
Fargeløs, toalett og smakløs gass; Mens ozon har en dekar lukt. Oksygen favoriserer forbrenning, men i seg selv er det ikke et drivstoff.
 Flytende oksygen. Kilde: Staff Sgt. Nika Glover, u.S. Luftforsvaret [Public Domain]
Flytende oksygen. Kilde: Staff Sgt. Nika Glover, u.S. Luftforsvaret [Public Domain] I sin flytende form (øvre bilde) er det blekblått, og krystaller er også blålige; Men de kan skaffe seg rosa, oransje og til og med rødlige toner (som det vil bli forklart i delen av strukturen).
Atomvekt
15.999 u.
Atomnummer (z)
8.
Smeltepunkt
-218,79 ºC.
Kokepunkt
-182.962 ºC.
Tetthet
Under normale forhold: 1 429 g/l. Oksygen er en tetteste gass enn luft. I tillegg er det en dårlig leder av varme og strøm. Og ved kokepunktet (væske) er tettheten 1.141 g/ml.
Trippelpunkt
54,361 K og 0,1463 kPa (14,44 atm).
Kritisk punkt
154,581 K og 5 043 MPa (49770,54 atm).
Fusjonsvarme
0,444 kJ/mol.
Fordampningsvarme
6,82 kJ/mol.
Molar kalorikapasitet
29,378 J/(mol · K).
Damptrykk
Ved en temperatur på 90 K har et damptrykk på 986,92 atm.
Oksidasjonsstater
-2, -1, +1, +2. Den viktigste oksidasjonsstatusen er -2 (eller2-).
Elektronegativitet
3.44 på Pauling -skalaen
Ioniseringsenergi
Først: 1.313,9 kJ/mol.
For det andre: 3.388,3 kJ/mol.
Tredje: 5.300,5 kJ/mol.
Magnetisk ordre
Paramagnetisk.
Vannløselighet
Oksygenløselighet i vann avtar når temperaturen øker. For eksempel: 14,6 ml oksygen/L vann blir oppløst ved 0 ºC og 7,6 ml oksygen/L vann ved 20 ºC. Oppløseligheten av oksygen i drikkevann er større enn i sjøvann.
I temperaturtilstanden 25 ºC og ved et trykk 101,3 kPa kan drikkevannet inneholde 6,04 ml oksygen/L vann; Mens sjøvann bare er 4,95 ml oksygen/L vann.
Reaktivitet
Oksygen er en svært reaktiv gass som reagerer direkte med nesten alle elementer ved romtemperatur og høye temperaturer; Bortsett fra metaller med høyere reduksjonspotensialer enn kobber.
Du kan også reagere med forbindelsene, oksidere elementene som er til stede i dem. Dette er hva som skjer når det reagerer med glukose, for eksempel for å produsere vann og karbondioksid; eller når treverket eller hydrokarbon brenner.
Oksygen kan akseptere elektroner ved fullstendig eller delvis overføring, så det regnes som et oksidasjonsmiddel.
Det vanligste oksidasjonsnummeret eller oksidasjonsstatusen er -2. Med dette oksidasjonsnummeret finnes det i vannet (h2O), svoveldioksid (så2) og karbondioksid (CO2).
Også i organiske forbindelser som aldehyder, alkoholer, karboksylsyrer; Vanlige syrer som H2SW4, H2Co3, Hno3; og i sine avledede salter: na2SW4, Na2Co3 ok nei3. I dem alle kan eksistensen av O antas2- (som ikke er sant for organiske forbindelser).
Oksider
Oksygen er til stede som eller2- I de krystallinske strukturer av metalloksider.
På den annen side, i metallsuperoksider, for eksempel kaliumsuperoksyd (KO2), oksygen er som ion eller2-. Mens du er i metallperoksider, for å si bariumperoksyd (Bao2), blir oksygen presentert som ionet eller22- (Ba2+ENTEN22-).
Isotoper
Oksygen har tre stabile isotoper: 16Eller, med 99,76% overflod; han 17Eller, med 0,04%; og 18Eller, med 0,20%. Merk at han 16Eller det er den desidert mest stabile og rikholdige isotopen.
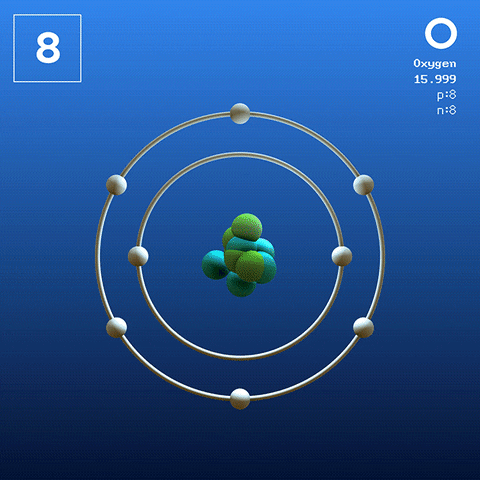
Elektronisk struktur og konfigurasjon
Oksygenmolekyl og interaksjoner
 Diatomisk oksygenmolekyl. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Diatomisk oksygenmolekyl. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Oksygen i sin basaltilstand er et atom hvis elektroniske konfigurasjon er:
[Han] 2s2 2 s4
I følge Valencia Link Theory (TEV) er to oksygenatomer koblet kovalent, slik at begge deler separat sin oktett av Valencia; I tillegg til å kunne parre de to ensomme elektronene i orbitalene 2p.
På denne måten vises oksygendiatomisk molekyl, eller2 (Høyere bilde), som har en dobbeltbinding (o = o). Energistabiliteten er slik at oksygen aldri blir funnet som individuelle atomer i gassfasen, men som molekyler.
Fordi o2 Han er homonukleær, lineær og symmetrisk, mangler permanent dipolmoment; Derfor avhenger dens intermolekylære interaksjoner av dens molekylmasse og spredningskreftene i London. Disse kreftene er relativt svake for oksygen, noe som forklarer hvorfor det er en gass under terrestriske forhold.
Men når temperaturen synker eller øker trykket, molekyler eller2 De blir tvunget til sammenhengende; til det punktet at interaksjonene deres blir betydelige og tillater dannelse av væske eller fast oksygen. For å prøve å forstå dem molekylært, er det nødvendig å ikke miste synet av O2 som strukturell enhet.
Ozon
Oksygen kan ta i bruk andre betydelig stabile molekylære strukturer; Det vil si at det finnes i naturen (eller i laboratoriet) i forskjellige allotropiske former. Ozonet (nedre bilde), eller3, For eksempel er det den andre alotropen til det mest kjente oksygenet.
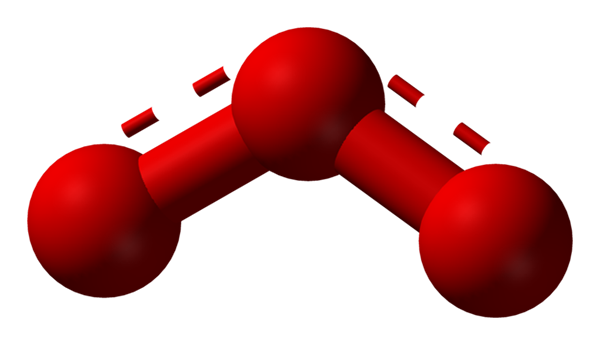 Struktur av resonanshybrid representert av en modell av sfærer og barer for ozonmolekylet. Kilde: Ben Mills via Wikipedia.
Struktur av resonanshybrid representert av en modell av sfærer og barer for ozonmolekylet. Kilde: Ben Mills via Wikipedia. Igjen, TEV holder, forklarer og demonstrerer det i OR3 Det må være resonansstrukturer som stabiliserer den positive formelle belastningen av sentrums oksygen (linjer prikket i rødt); Mens oksygen fra enden av boomerangen er en negativ belastning distribuert, noe som forårsaker den totale belastningen for ozon.
Kan tjene deg: Løselighetsregler: Generelle aspekter og reglerPå denne måten er ikke koblingene enkle, men ikke doble. Eksempler på resonanshybrider er veldig vanlige i så mange molekyler eller uorganiske ioner.
O2 Jeg3, Som et resultat av at deres molekylære strukturer er forskjellige, gjelder det samme for deres fysiske og kjemiske egenskaper, væske- eller krystallfaser (selv om begge bruker oksygenatomer). De teoretiserer den syntesen på store skalaer av syklisk ozon er sannsynlig, hvis struktur ligner den av en rødlig og oksygenert trekant.
Så langt ankommer de "normale alotropene" av oksygen. Imidlertid er det to andre å vurdere: o4 Jeg8, funnet eller foreslått i henholdsvis flytende og fast oksygen.
Flytende oksygen
Gassisk oksygen er fargeløs, men når temperaturen går ned til -183 ºC, kondenserer du i en blekblå væske (Celestial Lignende). Interaksjoner mellom molekyler eller2 Det er nå som elektronene deres kan absorbere fotoner i det røde området av det synlige spekteret for å gjenspeile dets karakteristiske blå farge.
Imidlertid er det blitt teoretisert at det i denne væsken er mer enn enkle molekyler eller2, men også et molekyl eller4 (Nedre bilde). Det virker som om ozon.
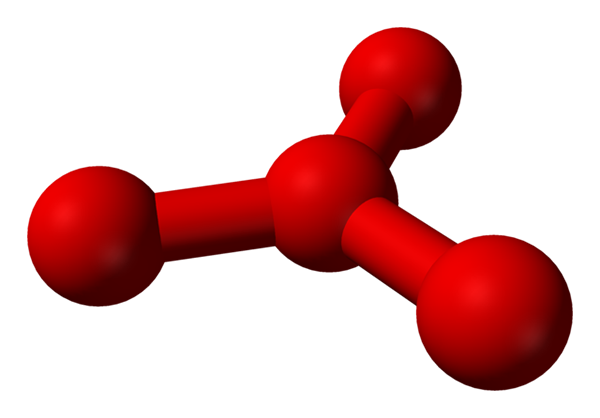 Modell foreslått struktur med kuler og barer for tetraoxygenmolekylet. Kilde: Benjah-BMM27 [Public Domain]
Modell foreslått struktur med kuler og barer for tetraoxygenmolekylet. Kilde: Benjah-BMM27 [Public Domain] Problemet er at ifølge datamaskin- og molekylære simuleringer, sa struktur for O4 Det er ikke nøyaktig stabilt; De spår imidlertid at de eksisterer som enheter (eller2)2, det vil si to molekyler av o2 De nærmer seg så mye at de danner en slags uregelmessig ramme (atomer eller ikke er på linje med hverandre).
Fast oksygen
Når temperaturen går ned til -218,79 ºC, krystalliserer oksygen seg i en enkel kubikkstruktur (γ -fase). Når temperaturen synker enda mer, lider kubikkglasset overganger til β -fasene (rhomboédica og ved -229,35 ºC) og α (monoklinisk og ved -249,35 ºC).
Alle disse krystallinske faser av fast oksygen forekommer ved omgivelsestrykk (1 atm). Når trykket øker til 9 GPa (~ 9000 atm), vises Δ -fasen, hvis krystaller er oransje. Hvis trykket fortsetter å øke til 10 GPa, vises det røde faste oksygenet eller fase ε (igjen monoklinisk).
Fase ε er spesielt fordi trykket er så stort at molekyler eller2 Ikke bare blir de innkvartert som enheter eller4, men også eller8:
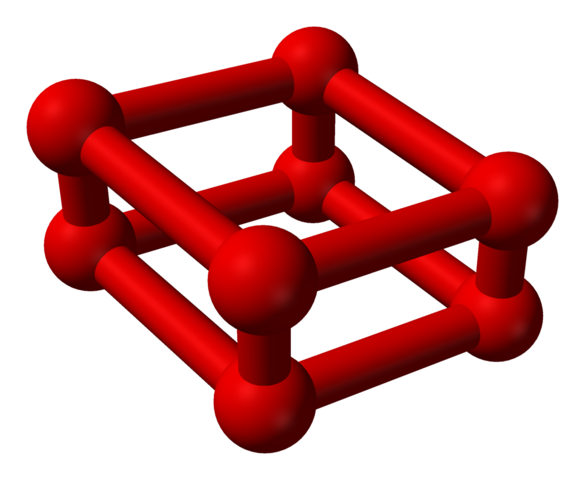 Modellstruktur med kuler og barer for octaoxygen -molekyl. Kilde: Benjah-BMM27 [Public Domain]
Modellstruktur med kuler og barer for octaoxygen -molekyl. Kilde: Benjah-BMM27 [Public Domain] Merk at dette eller8 Den består av to enheter eller4 der det uregelmessige rammeverket allerede er forklart. Det er også gyldig å betrakte det som fire eller2 tett justert og i vertikale posisjoner. Imidlertid er stabiliteten slik under dette presset at OR4 Jeg8 De er to ekstra alotroper for oksygen.
Og til slutt har vi fasen ζ, metallisk (til trykk større enn 96 GPa), der trykket får elektroner spredt i glasset; Som med metaller.
Hvor er og produksjon
Mineraler
Oksygen er i masse det tredje elementet i universet, bak hydrogen og helium. Det utgjør det mest tallrike elementet i jordskorpen, og representerer omtrent 50% av massen. Det er hovedsakelig kombinert med silisium, i form av silisiumoksid (SIO2).
Oksygen er en del av utallige mineral. På samme måte er det lokalisert som en del av mange forbindelser som karbonater, fosfater, sulfater, nitrater osv.
Luft
Oksygen utgjør 20,8% av atmosfærisk luft i volum. I troposfæren er det hovedsakelig som et diatomisk oksygenmolekyl. Mens du er i stratosfæren, er et gassformig lag mellom 15 og 50 km av jordoverflaten som ozon.
Ozon produseres av et elektrisk støt på molekylet til O2. Denne alotropen av oksygen absorberer det ultrafiolette lyset av solstråling, og blokkerer dens skadelige handling på mennesker, som i ekstreme tilfeller er assosiert med utseendet til melanomer.
Ferskt og salt vann
Oksygen er en hovedkomponent i sjøvann og ferskvann fra innsjøer, elver og grunnvann. Oksygen er en del av den kjemiske formelen for vann, og masserer 89% av det.
På den annen side, selv om løseligheten av oksygen i vannet er relativt lav, er mengden oksygen oppløst i dette viktig for vannlevende liv, som inkluderer mange arter av dyr og alger.
Levende vesener
Mennesket dannes, omtrent 60% av vannet og samtidig rik på oksygen. Men i tillegg er oksygen en del av mange forbindelser, for eksempel fosfater, karbonater, karboksylsyrer, ketoner, etc., som er essensielle for livet.
Oksygen er også til stede i polysakkarider, lipider, proteiner og nukleinsyrer; det vil si de så -kalt biologiske makromolekyler.
Det er også en del av skadelig avfall av menneskets aktivitet, for eksempel: karbondioksid og dioksid, samt svoveldioksid.
Biologisk produksjon
 Planter er ansvarlige for berikende oksygenluft i bytte mot karbondioksid som vi puster ut. Kilde: Pexels.
Planter er ansvarlige for berikende oksygenluft i bytte mot karbondioksid som vi puster ut. Kilde: Pexels. Oksygen forekommer under fotosyntesen, en prosess der marin planteplankton og terrestriske planter bruker lysenergi for å reagere karbondioksid med vann, forårsaker glukose og frigjøre oksygen.
Det anslås at mer enn 55% av oksygenet produsert ved fotosyntese skyldes virkningen av det marine planteplanktonet. Derfor utgjør det hovedkilden til oksygengenerering på jorden og er ansvarlig for å opprettholde livet i den.
Industriell produksjon
Luftflikt
Den viktigste industrielle oksygenproduksjonsmetoden opprettes i 1895, uavhengig av Karl Paul Gottfried von Linde og William Hamson. Denne metoden bruker for øyeblikket noen modifikasjoner.
Kan tjene deg: Butanone: Struktur, egenskaper og brukProsessen begynner med luftkomprimering for å kondensere vanndamp og eliminere den dermed. Deretter blir luften siktet når den utføres av en blanding av zeolit og silikagel, for eliminering av karbondioksid, tunge hydrokarboner og resten av vannet.
Deretter skilles komponentene i flytende luft gjennom en brøkdestillasjon, og oppnår separasjon av gassene som er til stede i sine forskjellige kokepunkter. Ved denne metoden oppnås oksygen med 99% renhet.
Vannelektrolyse
Oksygen produseres ved høyt renset vannelektrolyse, og med elektrisk ledningsevne som ikke overstiger 1 µs/cm. Vann skilles ved elektrolyse i komponentene. Hydrogen når kation beveger seg til katoden (-); Mens oksygen beveger seg mot anoden (+).
Elektrodene har en spesiell struktur for å samle gassene og deretter produsere deres flytende.
Termisk nedbrytning
Termisk nedbrytning av forbindelser som kvikksølvoksid og vert (kaliumnitrat), frigjør oksygen, som kan samles for bruk. Peroksider brukes også til dette formålet.
Biologisk papir
Oksygen produseres av planteplankton og landplanter gjennom fotosyntese. Den krysser lungeveggen og i blodet blir den fanget av hemoglobin, som transporterer det til forskjellige organer og deretter brukt i cellemetabolisme.
I denne prosessen brukes oksygen under metabolismen av karbohydrater, fettsyrer og aminosyrer, for til slutt å produsere karbondioksid og energi.
Puste kan skjematisere som følger:
C6H12ENTEN6 + ENTEN2 => Co2 + H2Eller +energi
Glukose metaboliseres i et sett med sekvensielle kjemiske prosesser, som inkluderer glykolyse, Krebs -syklusen, den elektroniske transportkjeden og oksidativ fosforylering. Denne serien med hendelser produserer energi som samler seg som ATP (Adenosín Triposphate).
ATP brukes i forskjellige prosesser i celler som inkluderer transport av ioner og andre stoffer gjennom plasmamembranen; tarmabsorpsjonen av stoffer; sammentrekningen av forskjellige muskelceller; Metabolismen av forskjellige molekyler osv.
Polymorfonukleære og makrofag leukocytter er fagocytiske celler som er i stand til å bruke oksygen for å produsere superoksydion, hydrogenperoksyd og enkelt oksygen, som brukes til å ødelegge mikroorganismer.
Risiko
Å puste oksygen til høyt trykk kan forårsake kvalme, svimmelhet, muskelspasmer, tap av syn, anfall og bevissthetstap. I tillegg forårsaker pusting av rent oksygen i lang tid lungestrang, manifestert ved hoste og en forkortelse av pust.
Det kan også være årsaken til dannelsen av et lungeødem: en veldig alvorlig tilstand som begrenser luftveiene.
En atmosfære med høy oksygenkonsentrasjon kan være farlig, siden den letter utviklingen av branner og eksplosjoner.
applikasjoner
Leger
Oksygen administreres til pasienter som har respirasjonssvikt; Slik er tilfellet med pasienter som er berørt av lungebetennelse, lungeødem eller emfysem. De kunne ikke puste miljøoksygen, da de ville bli alvorlig berørt.
Pasienter med hjertesvikt i det som blir presentert væskeakkumulering i alveoler trenger også oksygen for å bli tilført; Som pasienter som har fått en alvorlig vaskulær ulykke (hjerneslag).
Yrkesbehov
Brannmenn som kjemper mot brann i et miljø med upassende ventilasjon, krever bruk av masker og oksygenflaske som lar dem oppfylle funksjonene sine, uten å sette livet i større risiko.
Ubåter er utstyrt med oksygenproduksjonsutstyr som lar seilere holde seg i et lukket miljø uten atmosfærisk lufttilgang.
Dykkerne gjør arbeidet sitt nedsenket i vannet og derfor isolert fra atmosfærisk luft. De puster med oksygen pumpet av rør koblet til skanningen eller bruken av bomboner festet til kroppen til ubåten.
Astronauter utfører sine aktiviteter i miljøer utstyrt med oksygengeneratorer som tillater overlevelse under romturer og på en romstasjon.
Industriell
Mer enn 50% av det industrielt produserte oksygenet forbrukes i transformasjonen av jern til stål. Støpejernet injiseres med en oksygenstråle for å eliminere svovel og karbon til stede; reagere for å produsere så gasser2 og co2, henholdsvis.
Acetylen brukes i kombinasjon med oksygen for å kutte metallplater og også for å produsere sveising. Oksygen brukes også i glassproduksjon, og øker forbrenningen i bakingen for å forbedre åpenhet.
Atomabsorpsjonsspektrofotometri
Kombinasjonen av acetylen og oksygen brukes til å brenne prøver av forskjellig opprinnelse i et atomabsorpsjonsspektrofotometer.
Under prosedyren påvirkes en lysstråle fra en lampe av flammen, som er spesifikk for elementet som er ønsket å kvantifisere. Flammen absorberer lysets lys, og tillater kvantifisering av elementet.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Oksygen. Hentet fra: i.Wikipedia.org
- Richard Van Noordden. (13. september 2006). Bare en pen fase? Solid rød oksygen: ubrukelig, men herlig. Gjenopprettet fra: Naturen.com
- Azonano. (4. desember 2006). Fast oksygen E-fase krystallstrupt bestemt langs oppdagelsen av en oksygen O8-klynge. Gjenopprettet fra: Azonano.com
- Nasjonalt senter for bioteknologiinformasjon. (2019). Oksygenmolekyl. PubChem -database. CID = 977. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2019). Oksygenelement fakta. Chemicool. Gjenopprettet fra: Chemicool.com
- Robert c. Brazted. (9. juli 2019). Oksygen: kjemisk element. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Wiki -barn. (2019). Oksygenfamilie: egenskaper til via elementer. Gjenopprettet fra: enkelt.Vitenskap
- Advameg, inc. (2019). Oksygen. Gjenopprettet fra: makehow.com
- Lentech b.V. (2019). Periodebord: oksygen. Gjenopprettet fra: Lentech.com
- New Jersey Department of Health and Senior Services. (2007). Oksygen: Farlig stofffaktaark. [PDF]. Gjenopprettet fra: NJ.Gov
- Yamel Mattarollo. (26. august 2015). Industrielle oksygenindustrielle applikasjoner. Gjenopprettet fra: altecdust.com
- « Neonhistorie, egenskaper, struktur, risikoer, bruker
- Histidinegenskaper, struktur, funksjoner, mat »

