Histidinegenskaper, struktur, funksjoner, mat
- 1212
- 31
- Magnus Sander Berntsen
De Histidin (Hans, h) Det er en aminosyre som brukes til proteinsyntese. Det er et hydrofilt molekyl, så det er generelt orientert mot utsiden av proteinstrukturer når de er i et flytende medium.
Det regnes som en essensiell aminosyre for dyrking av barn siden de ikke produserer den. Hos den voksne er det en liten histidinproduksjon, men det er utilstrekkelig for å levere de daglige kravene, slik at det regnes som en halvt essensiell aminosyre.
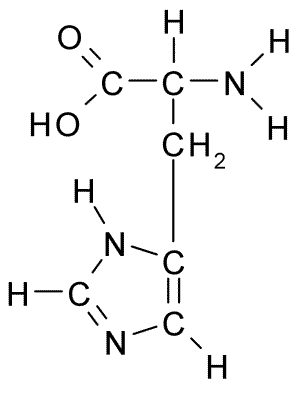
 Kjemisk struktur av histidinaminosyren (kilde: Borb, via Wikimedia Commons)
Kjemisk struktur av histidinaminosyren (kilde: Borb, via Wikimedia Commons) For dyr og mennesker er histidin en essensiell eller i det minste halvvesenlig aminosyre, men planter, sopp og mikroorganismer produserer effektivt histidinet de trenger og er en del av kostholdskildene til histidin, i tillegg til proteiner dyr.
Histidin oppfyller veldig viktige fysiologiske funksjoner i mennesket som: de som er en del av de aktive sentrene for mange enzymer, deltar i vekst, i immunsystemet og i dannelsen av myelin i nervefibre, blant andre.
Histidinbiosyntese er en kompleks prosess som hovedsakelig foregår i leveren og krever 9 til 11 enzymatiske trinn. Nedbrytningen skjer i leveren og huden og går gjennom dannelsen av glutamat, og deretter etter forskjellige stier.
Mange matvarer er rike på histidin, for eksempel animalsk proteiner som kjøtt og meieriprodukter, samt planteproteiner. Disse gir mye av de daglige kravene til histidin som kroppen vår trenger å fungere ordentlig.
Underskuddet eller overflødig histidin forårsaket av å arve metabolske eller transportproblemer, eller kostholdssvikt i inntak, er relatert til noen viktige problemer som påvirker helsen både hos barn og voksne. Tilstrekkelig histidinforbruk lar deg opprettholde et sunt og sunt liv i de fleste tilfeller.
[TOC]
Kjennetegn
Et fremhevende kjennetegn ved histidin er at det kan omdannes til histamin, et stoff som aktivt deltar i mange allergiske og inflammatoriske reaksjoner.
I fisken som er utsatt for miljøet uten tilstrekkelig kjøling, kan bakterier omdanne histidin til histamin, og det er grunnen til at de, når de blir inntatt, forårsaker matforgiftning.
Et annet kjennetegn ved denne aminosyren er at den er en av få, blant de eksisterende 22, som i området fysiologisk pH (rundt 7.4) Det er ionisert og kan derfor aktivt delta i det katalytiske stedet for mange enzymer.
I hemoglobinmolekylet er proksimal histidin en av hemokruppen ligander. Med andre ord, denne aminosyren deltar i oksygentransportfunksjonen til hemoglobin og er uunnværlig for syntesen av dette proteinet, så vel som for myoglobin, som også er kjent som "muskel hemoglobin".
Struktur
Histidin er en aminosyre Hydrofil Polar viktig, klassifisert innen essensielle aminosyrer, siden det ikke kan syntetiseres av dyr. Imidlertid, og som tidligere nevnt, syntetiseres det av bakterier, sopp og planter.
Hos voksende barn er histidin absolutt nødvendig; Den voksne kan syntetisere det, men det er ikke klart om dette dekker de daglige behovene til histidin, så det må inntatt med kostholdet.
Som alle aminosyrer har histidin et α -karbon som en aminogruppe, en karboksylgruppe, et hydrogenatom og en sidekjede er forbundet med.
Kan tjene deg: Coxiella BurnetiiSidekjeden til denne aminosyren dannes av en imidazolring som, til fysiologisk pH, protoner og får positiv belastning og kalles "Imidazolio " forkortet som IMH+.
Sammen med lysin og arginin danner histidin gruppen av basiske aminosyrer. Av de tre er histidin den minst grunnleggende, og dens imididoólica -ringen kan være ubeskyttet til pH nær 6.
Siden fysiologisk pH -histidin kan utveksle protoner, deltar dette vanligvis i enzymatisk katalyse som involverer overføring av protoner. I tillegg, siden det er en polar aminosyre, finnes den vanligvis på den ytre overflaten av proteinene, hvor den kan hydratere i et vandig medium.
Funksjoner
Som en del av det aktive enzymstedet
Histidin er nødvendig for syntese av mange proteiner, spesielt enzymer hvis aktive sentre har denne aminosyren. Det er en del av det aktive sentrum av pattedyrens aldlasaser, der det fungerer som en proton -giver.
Det ligger i det aktive sentrum av karboksipeptidase A, et bukspyttkjertelenzym som har et aktivt sted dannet av Zn og histidin. I det glykolitiske enzymet mutasa fosfoglyserat er det to histidinavfall i det aktive senteret som fungerer som akseptorer eller givere av fosforylgrupper.
Det finnes også i det aktive stedet for enzymer som glyseraldehyd 3-fosfatdehydrogenase, laktatdehydrogenase, papain, chimotripsin, rnasa A og ammoniakk liasa histidin (histidase). I tillegg er det en hemmer av enzymet glutaminsyntetase.
Andre funksjoner
Denne aminosyren er av stor betydning for organismen, siden dens dekarboksylase -histidin -dekarn.
Histidin produseres av nervesystemets nevroner med nevromodulerende funksjoner.
Det er nødvendig for dannelsen av myelinbeløp av nervefibre, så det oppfyller en viktig rolle i overføringen av elektriske impulser i dem.
Sammen med veksthormon og andre aminosyrer bidrar histidin til vevsreparasjonsmekanismer, hovedsakelig i det kardiovaskulære systemet.
Noen tilleggsfunksjoner inkluderer:
- Bidrar med avgiftning av noen tungmetaller siden det fungerer som chelatering.
- Beskytter mot skade forårsaket av stråling.
- Delta i dannelsen av røde og hvite blodlegemer.
- Det er nødvendig for hemoglobinformasjon.
- Det hjelper med å bekjempe noen negative effekter av revmatoid artritt som betennelse og mangel på mobilitet.
- Det er en viktig aminosyre for kapillærregenerering, vekst og seksuell funksjon.
Carnosine, Anserine og homocosin, er dipéptider dannet fra histidin. De to første finnes i musklene og har viktige funksjoner som tamponister og som aktivatorer av myosin atasa.
Homokosin produseres i hjernen i mengder 100 ganger høyere enn skjelettmuskel kjøttfull.
Biosyntese
Histidin oppnår sitt kullsyreholdige skjelett fra 5-fosfat ribose. I bakteriene OG. Coli, Denne aminosyren oppstår fra nevnte forbindelse ved hjelp av 11 enzymatiske trinn:
- Det første trinnet i syntesen består i overføringen av en fosforribosyl fra ATP til karbon 1 av 5-fosfat ribose, og genererer 5-fosforribosyl-1-pyrophosfat (PRPP) (PRPP). Fosphorribosyl-pyrofosfatsyntetase (PRPP-syntetase) enzym katalyserer denne reaksjonen.
- Deretter oppstår overføringen av karbonpyrofosfatgruppen 1 til N-1 av ATP, og N1- oppstår (5'-fosforribosyl) -ATP. Enzymet som katalyserer denne reaksjonen er ATP -fosforuseltransferase.
- Ved virkningen av fosforribosyl-pyrofosfathydroksylase er a, ß-pyofosfatkoblingen til ATP hydroksilase og N1- er dannet (5'-fosforribosyl) -AMP.
- Fosforribosyl-MAP-enzymhydroksylase åpner purinringen mellom N-1 og C-6 og ribonukleotidet dannes N1- (5'-fosforribosil formimino) -5-aminoimidazol-4-karboksamid-1-lribonukleotid.
- Deretter åpnes ribofuranosa-ringen som kommer fra PRPP og isomeriseres til en ketosa, og danner N1- (5'-fosforribosylformimimin) -5-aminoimidazol-4-karboksamid-1-lribonucleotid ved effekt av en isomerase-enzym.
- Aminotransferase-enzymet overfører den midtgruppen av glutamin, som blir glutamat, og bryter formiminlenken, så det frigjøres 5-aminoimidazol-karboksamid-1-lribonukleotid og imidazol-glyserolfosfatet genereres.
- Et vannmolekyl av imidazol-glyserolfosfat elimineres ved hjelp av imidazol-glyserolfosfatdehydratase og danner imidazol-acetol fosfat.
- Imidazol-acetolfosfat overføres en aminogruppe gjennom histidinoltransaminasefosfat og fosfathistidinol dannes.
- Den fosforiske estergruppen av histidinolfosfat for å danne histidinol er hydrolysert. Histidinolfosfatfospatase katalyserer denne reaksjonen.
- Senere oksideres histidinol ved histidinoldehydrogenase og er histidinal.
- Den samme histidinoldehydrogenase oksiderer til histidinalen og gjør det histidin.
Det første enzymet av den biosyntetiske ruten til histidin blir hemmet av produktets produkt, det vil si histidin deltar i den alestriske hemming av ATP -fosforribosyltransferase, som representerer hovedmekanismen for regulering av ruten.
Nedbrytning
Histidin, prolin, glutamat, arginin og glutamin er aminosyrer som når de ender opp med å danne α-zotoglaurat. Fire av dem blir først glutamat, som på grunn av transaminering gir opphav til α-ketoglutorat.
Histidin, gjennom histidinase, mister a-amino-gruppen for å bli urocanato. Deretter fukter urocanasen posisjonene 1 og 4 i urocanato, og danner 4-Midazolone-5-Propionate. Deretter oppstår iminogruppen til 4-Midazolone-5-Propionato, og danner n-formiminoglutamato.
Den siste reaksjonen innebærer overføring av formylen fra n-formiminoglutamatet til tetrahydrofolat, som fungerer med enzymet glutamatformiminøs overføring. Sluttproduktene av denne reaksjonen er glutamat og N5-formimino tetrahydrofolat.
Α-ketoglutarat dannes ved glutamattransaminering. Α-ketoglutarat er en mellomledd i Krebs-syklusen og kan også komme inn i den glukoneogene ruten for glukosedannelse.
Glutamato -aminogruppen kommer inn i urea -produksjonssyklusen som skal elimineres ved urin. Alle disse reaksjonene forekommer i leveren og en del av dem på huden.
Mat rik på histidin
De daglige histidinbehovene er omtrent 10 til 11 mg per kg kroppsvekt, per dag. Hos voksende barn er histidin en essensiell aminosyre som må leveres med kostholdet.
Hos andre dyr er histidin også en essensiell aminosyre, og de som er oppdrettet i staller, bør få histidin for å opprettholde sitt normale hemoglobinnivå.
Blant matvarene som er rike på histidin er:
- Storfekjøtt, lam, svinekjøtt, kylling og kalkun. Det finnes også i fisk som tunfisk (selv i hermetisert), laks, ørret, pargo og lubina, samt i litt sjømat.
Kan tjene deg: Blodkultur: Hva er det for, fundament, prosedyre, resultater- Melk og derivater, spesielt i modne oster som parmesan, Gruyere, sveitsisk ost, Gouda, blant andre. Hos de innfødte, i serumet, i yoghurten og i rømme.
- Soyabønner og nøtter som nøtter og frø. I solsikke, gresskar, vannmelon, sesam, mandler, pistasj, peanøttsmør og chia.
- Egg og bønner eller hvite bønner.
- Hele korn som quinoa, hvete, integrert ris, etc.
Fordelene med inntaket ditt
Det er en rekke patologiske forhold der histidin kan være nyttig som adjuvans for behandling.
Blant disse patologiene kan vi navngi revmatoid artritt, arteriell hypertensjon (siden en hypotensiv effekt av histidin er blitt beskrevet), i infeksjoner, frigiditet og sex og hørsel, magesår og anemier.
I huden produserer nedbrytningen av histidin som konsumeres urokansyre, som er i stand til å beskytte huden siden den absorberer ultrafiolette stråler.
Overskytende forbruk av friske individer gir ikke store endringer, siden det raskt blir nedbrutt. Imidlertid bør bruk av histidin kosttilskudd hos pasienter med alvorlige lever- og/eller nyreproblemer begrenses.
Mangelforstyrrelser
Histidinunderskuddet er relatert til endringer i immunresponsen på grunn.
Beinproblemer, døvhet og anemier assosiert med histidinunderskudd er også rapportert.
Hartnups sykdom er en arvelig tilstand som påvirker transport av histidin og tryptofan gjennom slimhinnen i tynn tarmen og nyrene, noe som forårsaker et underskudd på begge aminosyrene.
De mest relevante kliniske manifestasjonene er utseendet til schegous og røde lesjoner i huden etter soleksponering, forskjellige grader av bevegelsesendring og noen symptomer på psykiatriske sykdommer.
Histidinemi er en autosomisk recessiv sykdom som er preget av underskuddet av histidase -enzymet, noe som forårsaker en økning i konsentrasjonene av histidin i blod og urin.
Som en konsekvens kan ikke disse pasientene nedbryte histidin til urokal syre i leveren og huden. Denne sykdommen er ledsaget av moderat psykisk utviklingshemning, talefeil og auditive minne uten døvhet.
Begrensningen av histidininntak som behandling har ikke vært effektiv for å generere klinisk forbedring og innebærer risikoen for å generere vekstforstyrrelser hos barn som er berørt av denne sykdommen.
Referanser
- Mathews, c., Van Holde, K., & Ahern, K. (2000). Biokjemi (3. utg.). San Francisco, California: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Harpers illustrerte biokjemi (28. utg.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehninger prinsipper for biokjemi. Omega -utgaver (5. utg.). gjør jeg.org
- Percarz, p., Farri, l., & Papageorgiou, a. (1983). Effektene av morsmelk og lavproteinformler på hastighetene av total kroppsproteinskifte og urin 3-metylhistidinutskillelse av for tidlige spedbarn. Klinisk vitenskap, 64, 611-616.
- Sang, f. C., JOO, n., Aldini, g., & Yeum, k. (2014). Biologisk funksjon av histidindipeptider og metabolsk syndrom. Ernæringsforskning og praksis, 8(1), 3-10.
- « Oksygenegenskaper, struktur, risikoer, bruker
- Ekspertsystemhistorie, egenskaper, fordeler, ulemper »

