Oxidorreductases Egenskaper, struktur, funksjoner, eksempler
- 2338
- 377
- Markus Fredriksen
De oksidorreduktaser De er protein med enzymatisk aktivitet som har ansvaret for katalyserende reaksjoner av rustreduksjon, det vil si reaksjoner som innebærer fjerning av hydrogen- eller elektronatomer i underlagene de virker.
Reaksjonene katalysert av disse enzymene, som navnet tilsier, er oksydreduksjonsreaksjoner, det vil si reaksjoner der et molekyl donerer elektroner eller hydrogenatomer og en annen mottar dem, og endrer sine respektive oksidasjonstilstander.
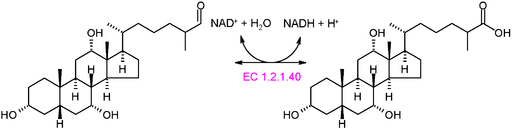 Grafisk skjema for reaksjonen av en oksidortase av type EC 1.2.1.40 (Kilde: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons)
Grafisk skjema for reaksjonen av en oksidortase av type EC 1.2.1.40 (Kilde: Akane700 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons) Eksempel på veldig vanlige oksidortiske enzymer i naturen er dehydrogenaser og oksidaser. Det kan nevnes enzymet av alkoholdehydrogenase, som katalyserer dehydrogenering av etanol for å produsere acetaldehyd i en NAD+ avhengig eller omvendt reaksjon, for å produsere etanol under alkoholholdig gjæring utført av noen kommersielt viktige gjær.
Enzymene i elektrontransportørkjeden i de aerobe cellene er oksider som har ansvaret for pumping av protoner, slik at de genererer den elektrokjemiske gradienten gjennom den indre mitokondrielle membranen som gjør det mulig å øke syntesen av ATP.
[TOC]
Generelle egenskaper
Oksidoreduktase -enzymer er enzymer som katalyserer oksidasjonen av en forbindelse og samtidig reduksjon av en annen.
Disse krever normalt tilstedeværelse av forskjellige typer koenzymer for deres drift. Coenzymes oppfyller funksjonen til å donere eller akseptere.
Disse koenzymene kan være NAD+/NADH Torus eller FAD/FADH2 -dreiemomentet. I mange aerobe metabolske systemer overføres disse elektronene og hydrogenatomer fra de koenzymene som er involvert til oksygen.
De er enzymer med en uttalt "mangel" på substratspesifisitet, slik at de kan katalysere kryssreaksjoner i forskjellige typer polymerer, enten det er protein eller karbohydrater.
Klassifisering
Mange ganger er nomenklaturen og klassifiseringen av disse enzymene basert på både hovedunderlaget de bruker og typen koenzym de trenger for å fungere.
I henhold til anbefalingene fra nomenklaturutvalget til International Union for Biochemistry and Molecular Biology (NC-IBMB), tilhører disse enzymene klasse E.C. 1 og inkluderer mer eller mindre 23 forskjellige typer (e.C.1.1-e.C.1.23), som er:
Kan tjene deg: erytropoietin (EPO): egenskaper, produksjon, funksjoner- OG.C. 1.1: som fungerer i CH-OH-gruppene av givere.
- OG.C. 1.2: Hvilken handling i aldehydgruppen eller Oxo de los donorgruppen.
- OG.C. 1.3: som fungerer i CH-CH-gruppene av givere.
- OG.C. 1.4: som fungerer i CH-NH2-gruppene av givere.
- OG.C. 1.5: som fungerer i CH-NH-gruppene av givere.
- OG.C. 1.6: Hvilken handling i NADH eller NADPH.
- OG.C. 1.7: Hvilken handling på andre nitrogenforbindelser som givere.
- OG.C. 1.8: Hvilken handling på svovelgruppene av givere.
- OG.C. 1.9: som fungerer i hemo -gruppene av givere.
- OG.C. 1.10: som fungerer i givere som difenoler og andre relaterte stoffer.
- OG.C. 1.11: Hvilken handling på peroksyd som en akseptor.
- OG.C. 1.12: Hvilken handling på hydrogen som giver.
- OG.C. 1.13: som virker på enkle givere med inkorporering av molekylært oksygen (oksygenaser).
- OG.C. 1.14: som fungerer på "sammenkoblede" givere, med inkorporering eller reduksjon av molekylært oksygen.
- OG.C. 1.15: som fungerer på superoksider som akseptorer.
- OG.C. 1.16: som oksiderer metallioner.
- OG.C. 1.17: Hvilken handling på CH2 -grupper.
- OG.C. 1.18: som virker på proteiner som inneholder jern og antar som givere.
- OG.C. 1.19: Hvilken handling på redusert flavodoksin som giver.
- OG.C. 1.20: som handler på givere som fosfor og arsen.
- OG.C. 1.21: som fungerer i reaksjonen x-h + y-h = x-y.
- OG.C. 1.22: Hvilken handling på halogen av givere.
- OG.C. 1.23: som reduserer C-O-C-grupper som akseptorer.
- OG.C. 1.97: Andre OxsidoryDuctases.
Hver av disse kategoriene inkluderer også undergrupper der enzymer skilles fra i henhold til preferansen til underlag.
Kan tjene deg: Primær suksess: Kjennetegn og eksemplerFor eksempel, innenfor gruppen av oksidoreduktaser som virker på CH-OH-gruppene av deres givere, er det noen som foretrekker NAD+ eller NADP+ som akseptorer, mens andre bruker cytokromer, oksygen, svovel osv.
Struktur
Ettersom gruppen av oksidoreduktaser er ekstremt mangfoldig, er det ganske komplisert å etablere en definert strukturell egenskap. Strukturen varierer ikke bare fra enzym til enzym, men også mellom arter eller gruppe av levende vesener og til og med celle til celle i forskjellige vev.
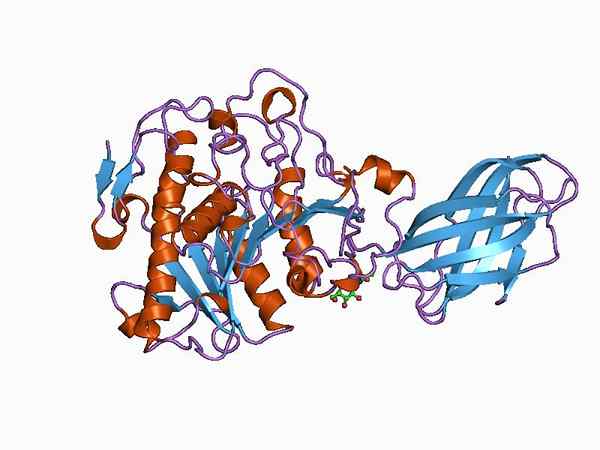
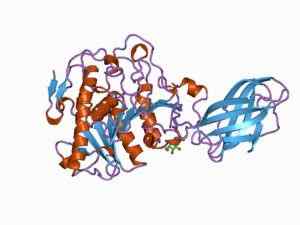 Bioinformatikkmodell av strukturen til et oksyduktase -enzym (kilde: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Bioinformatikkmodell av strukturen til et oksyduktase -enzym (kilde: Jawahar Swaminathan og MSD -ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Enzymet pyruvatdehydrogenase, for eksempel, er et kompleks sammensatt av tre sekvensielt koblede katalytiske underenheter og kjent som E1 -underenheten (dehydrogenase piruvat), E2 -underenheten (dihydrolipamid -acetyltransferase) og E3 -underenheten (Dihydrolipamid -acetyltransferase).
Hver av disse underenhetene kan på sin side være sammensatt av mer enn ett proteinmonomer av samme type eller av forskjellige typer, det vil si at de kan være homodimeriske (de med bare to like monomerer), heterotrimérica (som har tre monomerer forskjellige) og så videre.
Imidlertid er det vanligvis enzymer sammensatt av alfahaller og ß-belagte ark arrangert i forskjellige former, med spesifikke intermolekylære interaksjoner av forskjellige typer forskjellige typer.
Funksjoner
Oksidorterte enzymer katalyserer oksydreduksjonsreaksjoner praktisk talt i alle celler fra alle levende vesener på biosfæren. Disse reaksjonene er generelt reversible, der oksidasjonstilstanden til ett eller flere atomer i samme molekyl blir endret.
Vanligvis trenger oksidorestonene to underlag, en som fungerer som en giver av hydrogen eller elektroner (som oksiderer) og en annen som fungerer som en akseptor for hydrogen eller elektroner (som er redusert).
Disse enzymene er ekstremt viktige for mange biologiske prosesser i forskjellige typer celler og organismer.
De fungerer for eksempel i syntesen av melanin (et pigment som dannes i cellene i huden til mennesker), i dannelse og nedbrytning av lignin (strukturell forbindelse av planteceller), ved folding av proteiner, etc.
Det kan tjene deg: arter introdusert på Galapagos -øyeneDe brukes industrielt til å endre strukturen til noen matvarer, og eksempel på disse er peroksidaser, oksidase glukose og andre.
I tillegg er de mest fremtredende enzymer i denne gruppen de som deltar som elektroniske transportører i transportørkjedene til mitokondriell membran, kloroplaster og indre plasmamembran av bakterier, hvor de er transmembranale proteiner.
Eksempler på Oxidortas
Det er hundrevis av eksempler på oksiderte enzymer i naturen og industrien. Disse enzymene har som nevnt funksjoner av største betydning for cellulær funksjon og derfor for livet per se.
Oksididuktaser inkluderer ikke bare peroksidase -enzymer, lakk, oksidase -glukose eller dehydrogen alkohol; De kombinerer også viktige komplekser som glyseraldehydenzymet 3-fosfatdehydrogenase eller komplimenus dehydrogenase, etc., essensielt fra synspunktet av glukosekatabolisme.
Det inkluderer også alle enzymer av det elektroniske transportkomplekset i den indre mitokondrielle membranen eller i den indre membranen til bakterier, lik noen av enzymer som finnes i kloroplastene til planteorganismer.
Peroksidaser
Peroksidaser er veldig forskjellige enzymer og bruker hydrogenperoksyd som elektronakseptor for å katalysere oksidasjon av en rekke underlag, inkludert fenoler, aminer eller thioles, blant andre. I reaksjonene reduserer de hydrogenperoksyd til det produserer vann.
De er veldig viktige fra det industrielle synspunktet, og er peroksidasen til den krydret reddik den viktigste og mest studerte av alle.
Biologisk sett er peroksidaser viktig for eliminering av reagens oksygenforbindelser som kan forårsake betydelig skade på celler.
Referanser
- Britannica Encyclopaedia. (2019). Hentet 26. desember 2019, fra www.Britannica.com
- Ercili-Cura, d., Hupperz, t., & Kelly, a. L. (2015). Enzymatisk modifisering av melkeproduktstruktur. I å endre mattekstur (pp. 71-97). Woodhead Publishing.
- Mathews, c. K., Van Holde, K. OG., & Ahern, K. G. (2000). Biokjemi. LEGG TIL. Wesley Longman, San Francisco.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger prinsipper for biokjemi. Macmillan.
- Nomenklaturutvalg for International Union of Biochemistry and Molecular Biology (NC-IBMB). (2019). Hentet fra www.QMUL.Ac.UK/SBCS/IUBMB/enzym/indeks.Html
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, f. (2014). Pyruvatdehydrogenase-kompleksene: Struktur-basefunksjon og regulering. Journal of Biological Chemistry, 289 (24), 16615-16623.

