Pencanona kjemisk struktur, egenskaper, syntese, bruk
- 1473
- 113
- Oliver Christiansen
De Pentanona Det er en organisk forbindelse som tilhører familien til ketonene, hvis kjemiske formel er C5H10ENTEN. Det er fortsatt en av de enkleste ketonene, og består av en fargeløs væske med en aroma som ligner på aceton. Fra det fra nå av, med hensyn til karbonnummeret til skjelettet deres, presenterer ketonene posisjonsisomer.
Når du snakker om posisjon Isomeria refererer til hvor karbonylgruppen er, c = o. Dermed består Puntanona faktisk av to forbindelser med fysiske egenskaper som knapt skiller seg fra hverandre: 2-Penone og 3-Penone (lavere bilde). Begge er flytende, men kokepunktene deres er de samme, så de kan ikke skilles ved destillasjon.
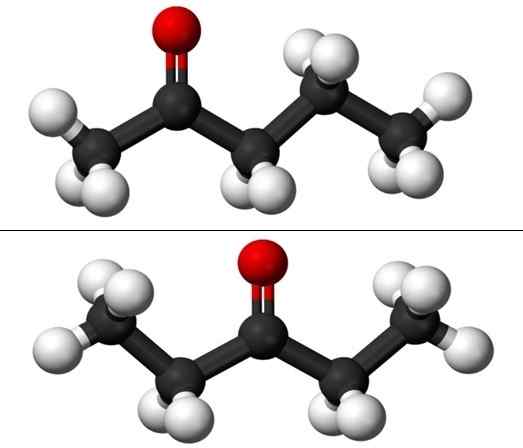
 Molekyler av posisjonsisomerer for pentanona. Kilde: Jynto & Ben Mills via Wikipedia.
Molekyler av posisjonsisomerer for pentanona. Kilde: Jynto & Ben Mills via Wikipedia. Imidlertid har hver av de to pentanonene sin egen syntese rute, så det er lite sannsynlig at det er en blanding av dem; blanding som kan være mulig å skille ved frysing.
Bruken er begrenset spesielt som organiske løsningsmidler; Alternativer til aceton i media hvor du jobber med en temperatur som er høyere enn det lave kokepunktet. De er også startmaterialer for annen organisk syntese, ettersom gruppen C = O kan redusere eller lide nukleofil tilsetning.
[TOC]
Kjemisk struktur
Posisjonsisomerer
På bildet har vi molekylære strukturer i de to posisjonsisomerer for Puntanona, representert med en modell av kuler og barer. De svarte kulene tilsvarer kullsyreholdige skjeletter, hvite til hydrogenatomer og røde oksygenatomer i gruppe C = O.
2-pintanon
2-Ponanona (over) har gruppe C = eller i det andre karbonet, noe som tilsvarer hvis det var i rommet; Det vil si at 2-Ponanona og 4-pantanona er likeverdige, siden det er nok til å rotere dem 180º slik at strukturene deres er de samme.
Kan tjene deg: karbontetraklorid (CCL4)Til venstre for C = o har du en metylradikal, Cho3-, Og til høyre for en radikal propil. Det er grunnen til at denne Cetona også mottar navnet (mindre brukt) fra Metil Propil Cetona (MPK på engelsk). Du kan se asymmetrien til denne strukturen ved første blikk.
3-Penone
3-péntanona (under) har gruppe C = O i det tredje karbonet. Merk at denne isomeren er en større versjon av aceton, og at den også er veldig symmetrisk; De to radikaler på sidene av gruppe C = O er de samme: to etylradikaler, CH3Ch2-. Det er grunnen til at 3-Pananona også kalles Cetona Diestil (eller dimetylaceton).
Intermolekylære interaksjoner
Tilstedeværelsen av karbonylgruppen, både i 2-pantanon og i 3-Penona, gir polaritet til molekylet.
Derfor er begge Pentanona-isomerer i stand til å samhandle med hverandre gjennom dipole-dipol.
På samme måte griper London -spredningskrefter mellom karbon og hydrogenerte skjeletter i mindre grad.
Ved å ha Puntanona, et større molekylært område og masse sammenlignet med acetonens, gir dette bidraget til dipolmomentet og lar et høyere kokepunkt (102 ºC> 56 ºC) ha et høyere kokepunkt). Faktisk fordamper de to isomerer ved 102 ºC; Mens de fryser ved forskjellige temperaturer.
Krystaller
Sannsynligvis i krystallisering spiller symmetriene en viktig rolle. For eksempel er fusjonspunktet til 2 -pantanona -78 ºC, mens 3 -péntanona, -39 ºC.
Kan tjene deg: Avogadro LawDette betyr at 3-pantanona-krystaller er mer stabile mot temperatur; Molekylene er mer sammenhengende og krever mer varme for å skille seg i væskefasen.
Hvis det var en blanding av begge isomerer, ville 3-Penone være den første til å krystallisere, og til slutt var 2-Pananona ved en lavere temperatur. Molekylene til 3-pantanon, mer symmetrisk, er lettere orientert enn for 2-ponanona: asymmetrisk og samtidig mer dynamisk.
Egenskaper
Fysisk utseende
Fargeløse væsker med en aroma som ligner på aceton.
Molmasse
86,13 g/mol
Tetthet
0,81 g/ml (3-Ponanona)
0,809 g/ml (2-ponanona)
Smeltepunkt
-78 ºC (2-Ponanona)
-39 ºC (3-Ponanona)
Kokepunkt
102 ºC (for begge isomerer)
Vannløselighet
35 g/l (3-Ponenona)
60 g/l (2-Ponenona)
Damptrykk
35 mmHg (3-Ponenona)
270 mmHg (2-pantanon) ved 20 ºC
Disse verdiene er ikke nyttige for å direkte sammenligne damptrykket til begge isomerer, ettersom den første rapporteres uten temperaturen som den ble målt.
Flash Point
12,78 ºC (3-Ponanona)
10 ºC (2-Ponanona)
Stabilitet
De to Pentanona -isomerer er ekstremt brennbare, så de må forbli så langt borte fra enhver varmekilde. Flash -punkter indikerer at en flamme kan stille damper til begge pentanene selv ved en temperatur på 10 ºC.
Syntese
Selv om de to Pentanona -isomerer er fysisk og kjemisk veldig like, er deres syntetiske ruter uavhengige av den andre, så det er lite sannsynlig at begge er oppnådd i samme syntese.
2-pintanon
Fra og med 2-penol-reagenset, en sekundær alkohol, kan dette oksideres til 2-ponanon ved bruk av hypoklorsyre dannet in situ, Hclo, som et oksidasjonsmiddel. Oksidasjon ville være:
Det kan tjene deg: Ingen elektrolytter: Kjennetegn og eksempler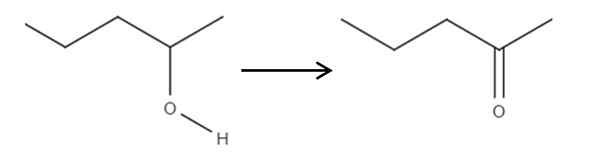 Oksidasjon av 2-pantanol ved 2-pantanona. Kilde: Gabriel Bolívar.
Oksidasjon av 2-pantanol ved 2-pantanona. Kilde: Gabriel Bolívar. Ganske enkelt C-OH-koblingen blir C = O. Det er andre metoder for å syntetisere 2-Penona, men dette er det enkleste å forstå.
3-Penone
3-pintanonen kan syntetiseres med måter3Ch2COOH. Denne syntetiske ruten produserer symmetriske ketoner, og er at et Cho -molekyl3Cooh vil miste Cooh -gruppen i form av CO2, Mens den andre gruppen din oh i form av h2ENTEN:
2ch3Ch2COOH => CH3Ch2Coch2Ch3 + Co2 + H2ENTEN
En annen litt mer kompleks rute er å direkte reagere en blanding av etylen, CHO2= Ch2, Co2 og h2 Å danne 3-Ponanona.
applikasjoner
Med mindre applikasjonen er veldig streng, er det en spesifikk syntese, eller at det også er vist at de to isomerer ikke forårsaker de samme resultatene, er det uten betydning å velge mellom å bruke 2-Penone eller 3-Penone i noen av dens bruker.
Det vil si "Det betyr ikke noe" hvis du vil bruke 2-Ponanona eller 3-Penona som et løsningsmiddel av malerier eller harpikser, eller som en elendig, fordi de viktigste kriteriene vil bli dens pris og tilgjengelighet. 3-Penone brukes i bilindustrien for å studere atferden til gasser i forbrenningsmotorer.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Wikipedia. (2019). 3-smerte. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). 2-pontenon. PubChem -database. CID = 7895. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Royal Society of Chemistry. (2019). 3-smerte. Gjenopprettet fra: Chemspider.com
- Professor t. Nalli. (2013). Oksidasjon av 2-pintanol og destillasjon av produktet. Gjenopprettet fra: kurs1.Winona.Edu

