Hydrogenperoksyd (H2O2) struktur, egenskaper, bruk, oppnå

- 3335
- 473
- Markus Fredriksen
Han hydrogenperoksyd Det er en uorganisk forbindelse hvis kjemiske formel er h2ENTEN2. Alle er det enkleste peroksydet til denne familien av kjemiske forbindelser. Den strukturelle formelen er H-O-H-H, og denne indre oksygenerte broen er karakteristisk for alle peroksider.
I 1818, h2ENTEN2 Det ble identifisert av Louies Jacques Thénard, som forberedte en kjemisk forbindelse som han ba om da Huzigenada. Det er en ustabil forbindelse, dekomponerer ved eksponering for lys, varme og noen metaller.
 Kjemisk formel av hydrogenperoksyd
Kjemisk formel av hydrogenperoksyd Det er en veldig nyttig forbindelse som brukes i desinfeksjon av mindre sår, hårbleking, vannbehandling, etc. Selv om han kan ha skadelige handlinger for mennesket, finnes det i alle eukaryote celler fra levende vesener, hvor han utfører flere gunstige funksjoner.
Hydrogenperoksyd produserer oksidasjon av giftige stoffer som fenoler, etanol, formaldehyd, etc., Produkter som elimineres av leveren og nyrene. I tillegg bidrar det til ødeleggelse av bakteriene som er fagocytet av neutrofil og makrofag leukocytter.
[TOC]
Struktur
Molekyl
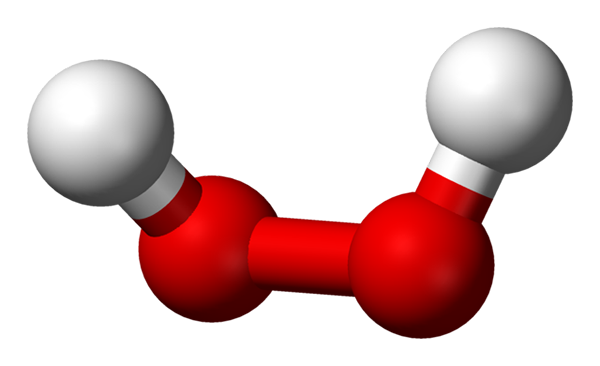 Hydrogenperoksydmolekyl representert med en kuler og barer -modell. Kilde: Benjah-BMM27 via Wikipedia.
Hydrogenperoksydmolekyl representert med en kuler og barer -modell. Kilde: Benjah-BMM27 via Wikipedia. I det overlegne bildet kan strukturen til H -molekylet sees2ENTEN2 (H-O-O-H), med de røde kulene som tilsvarer oksygenatomer og hvite hydrogenatomer. Merk at molekylet ikke er flatt, og at verken atomene h er formørket i verdensrommet (den ene foran den andre).
Interessant nok, til H2ENTEN2 Det er vanskelig å rotere sin enkle sentrale kobling O-O, så posisjonene til disse H ikke kan byttes; Den ene vil ikke gå ned mens den andre går opp.
Fordi? For i de to oksygenatomene er det to elektronfrie par, som gir totalt åtte veldig nære elektroner og som frastøter hverandre for deres negative ladninger.
Rotasjoner
Likevel vil sannsynligvis O-O-lenken rotere på grunn av interaksjoner med omgivelsene.
For eksempel, når de sammen med de to tommelen, med fingrene forlenget og de andre stengte, for eksempel å tegne en domstol, og deretter vri tommelen på en slik måte at en av fingrene retter seg fremover og den andre bakover, vil det være en omtrentlig representasjon av h2ENTEN2.
Hvis en kropp spiller noen av indeksene, vil tommelen rotere som svar på dette samspillet; Imidlertid vil de umiddelbart komme tilbake til sin opprinnelige posisjon på grunn av de elektroniske frastøttene som er nevnt ovenfor. Disse rotasjonene rammer de dynamiske aspektene ved dette molekylet.
Intermolekylære interaksjoner
I flytende tilstand h2ENTEN2 klarer å etablere hydrogenbroer (HOOH-O2H2), ellers ville det høye kokepunktet (150 ºC) ikke bli forklart sammenlignet med vannet.
Kan tjene deg: kalsiumsulfat (case4): kjemisk struktur, egenskaper, brukNår den har gått til gassfasen, M -molekylene2ENTEN2 Antagelig kan ikke lenger danne slike broer, ikke bare til den største intermolekylære avstanden, men også hydrogenatomene ville være de første som blir berørt i tilfelle kollisjoner (dette kan visualiseres ved å ty tilbake til fingersmodellen).
I mellomtiden, i fast fase, er vinkelen på planene som etablerer H 90º (legg vinkelrett fingrene) fingrene). Nå blir hydrogenbroer enda viktigere og H -molekyler2ENTEN2 De bestilles i en tetragonal struktur krystall.
Egenskaper
Sbotella med hydrogenperoksyd. Hos apotek oppnås det med en konsentrasjon på 3% m/v. Kilde: Pixnio.
Navn
-Hydrogenperoksyd
-Dioxidano
-Oksidanol
-Perhydoksinsyre
-O-hydroksyol
-Hydrogenperoksyd
Molmasse
34.0147 g/mol
Fysisk utseende
Blekblå (konsentrert) eller fargeløs. Det er litt mer tyktflytende og tett enn vann. Det er destillert for sikkerhet ved lave temperaturer og redusert trykk, siden det dekomponerer ved eksplosivt oppvarming.
Lukt
Akutt eller en lukt som ligner på ozon.
Smak
Bitter
Tetthet
Solid 1,71 g/cm3
Tettheten av deres vandige oppløsninger avhenger av konsentrasjonen; For eksempel har 27 % en tetthet på 1,10 g/cm3, mens 50 %, 1,13 g/cm3
Smeltepunkt
- 0,43 ºC
Kokepunkt
150,2 ºC. Denne verdien er oppnådd ved ekstrapolering, siden hydrogenperoksyd dekomponerer ved høye temperaturer.
Vannløselighet
Blandbar ≥ 100 mg/ml ved 25 ° C
Løselighet
Det er løselig i eter og alkoholer, men uoppløselig i oljeeter. Det dekomponerer i vann og oksygen i mange organiske løsningsmidler.
Oktanol/vannpartisjonskoeffisient
Logg P = - 0,43
Damptrykk
5 mmHg ved 30 ºC.
Dissosiasjonskonstant
PKA = 11,72
Ph
Hydrogenperoksydløsninger er svakt syrlige. For eksempel har en til 35% en pH på 4,6; Men når de konsentrerer seg ved 90%, blir pH mindre sur: 5.1.
Brytningsindeks (nD)
1.4061
Goo
1.245 CPOISE ved 20 ° C.
Varmekapasitet
1 267 j/g · k (gass)
2.619 J/g · K (væske)
Fordampningsvarme
1.519 j/g · k
Stabilitet
Stabil under anbefalte forhold. Tilsetningen av acetanylid og tinnsalter stabiliserer det mer.
Korrosjon
Etsende
Nedbrytning
Den dekomponerer ved eksponering for lys eller i nærvær av oksiderende og reduserende stoffer. Det er også brutt ned ved oppvarming. Når det blir beslaglagt, frigjøres vann og oksygen, og foretrukket av en økning i pH og temperatur, så vel som med tilstedeværelsen av katlaseenzymet.
Kan tjene deg: natriumperoksyd (Na2O2): struktur, egenskaper, brukOverflatespenning
80,4 DINS/CM A 20 ºC
Reaktivitet
H2ENTEN2 Det fungerer som et oksidasjonsmiddel i syreoppløsninger av jern (tro2+) Jernjern (f3+); oksiderer også sulfittion (så32-) til sulfation (så42-).
Det kan også fungere som et reduserende middel i nærvær av basiske løsninger, og reduserer til natriumhypokloritt (NaOCL) og kaliumpermanganat (KMNO4) Med oksygenfrigjøring.
applikasjoner
Whitening
Hydrogenperoksyd brukes i papirindustrien i bleking av masse og papir, som bruker mesteparten av sin årlige produksjon.
Desinfeksjonsmiddel
Hydrogenperoksyd er et mildt antiseptisk middel for å unngå lite sårinfeksjon, skraper og forbrenninger. Det brukes også som munnskyll og for å lindre mild munnirritasjon på grunn av tilstedeværelsen av munnstykker eller gingivitt.
Det brukes også til å desinfiske overflater, interiøret i kjøleskap, vann og bekjempe overdreven bakterievekst i vannsystemer og kjøletårn. Hydrogenperoksyd frigjør oksygenfrie radikaler, som dekomponerer miljøgifter.
Vaskemiddel
Hydrogenperoksyd brukes til fremstilling av blekingsvaskemidler i klærne, inkludert natriumkarbonat. Denne forbindelsen er et kompleks av natriumkarbonat og hydrogenperoksyd som er oppløst i vannet skiller seg i komponentene.
Kosmetisk anvendelse
Fortynnet hydrogenperoksyd brukes i hårbleking, før farging. Det brukes også til å bleke tennene, som en del av en hjemmelaget tannkrem.
Drivmiddel
Hydrogenperoksyd brukes som en monoporpellant eller oksidasjonskomponent i en bipropoonous rakett. Det brytes ned frigjør oksygen og vann, et kjennetegn som tillot dets bruk som drivmiddel.
En reaksjonscelle pumpes med tilstedeværelsen av en katalysator som akselererer nevnte nedbrytning. I løpet av dette produseres vanndamp ved høy temperatur.
Når damp blir utvist gjennom et gap, produserer en impuls. V-80-ubåten bygget i 1940, brukt i oksygenturbinene generert fra hydrogenperoksyd; kalt Walter Turbine System.
Å skaffe
Opprinnelig ble hydrogenperoksyd oppnådd industrielt ved hydrolyse av ammoniumpersulfat, [(NH4)2S2ENTEN8] eller elektrolyse av ammoniumbisulfat, NH4HSO4.
Hydrogenperoksyd oppnås industrielt ved bruk av antraquinon. Prosessen utføres i fire stadier: hydrogenering, filtrering, oksidasjon, ekstraksjon og rensing.
Kan tjene deg: magnesiumfluor: struktur, egenskaper, syntese, brukHydrogenering
Alquilantroquinona hydrogeneres ved å føre hydrogengass gjennom en hydrogenator lastet med aluminiumoksyd og en liten mengde katalysator (paladium). Temperaturen opprettholdes ved 45 ºC med permanent agitasjon.
Alkyndrokinonet omdannes til alquiloantrahydroquinona og tetrahydroalquilantrahydroquinon, og velger sistnevnte for sin største bekvemmelighet for følgende prosedyrer.
Filtrering
Løsningen inneholdt.
Oksidasjon
Den filtrerte løsningen oksiderer ved å føre luft gjennom den, og danner hydrogenperoksyd med lav renhet.
Ekstraksjon og rensing
Løsningen med hydrogenperoksyd krysser en væske-væskeekstraksjonskolonne. Vann strømmer gjennom kolonnen, mens løsningen med hydrogenperoksyd pumpes av den.
Vannet når bunnen av avtrekkeren med en konsentrasjon av hydrogenperoksyd mellom 25 og 35 % P/P. Deretter blir det renset ved vakuumdestillasjon, til en 30 % hydrogenperoksydkonsentrasjon. Endelig stabilisert og lagret.
Risiko
 Hydrogenperoksydforbrenning. Kilde: Bobjgalindo [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Hydrogenperoksydforbrenning. Kilde: Bobjgalindo [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Hydrogenperoksyd er et etsende middel, så hudkontakten gir alvorlig irritasjon, i tillegg til midlertidig bleking (overlegen bilde). Det kan også produsere øyeskader, kløe, salpt, rødhet og ampulesformasjon.
Innånding gir irritasjon i nesen, halsen og lungene. I mellomtiden kan gjentatt eksponering forårsake bronkitt, hoste, slim og pusteforkortelse. Og som om det ikke var nok, genererer det også hodepine, vahid, kvalme og oppkast.
Alvorlig eksponering for hydrogenperoksyd kan produsere flytende akkumulering i lungene, som er kjent som et lungeødem: alvorlig tilstand som krever rask legehjelp.
Arbeidsmiljøet og helseadministrasjonen (OSHA) har etablert det maksimalt tillatte for hydrogenperoksyd på 1 ppm i et arbeidsmiljø på en 8 -timers dag. Imidlertid, ettersom det er en mutagen forbindelse, må eksponering for minimum reduseres.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Hydrogenperoksyd. Hentet fra: i.Wikipedia.org
- William R. Buss og Henri a. LEVY. (2004). Krystall- og molekylær struktur av hydrogenperoksyd: en nøytron -diffraksjonsstudie. gjør jeg.org/10.1063/1.1696379
- Nasjonalt senter for bioteknologiinformasjon. (2019). Hydrogenperoksyd. PubChem -database. CID = 784. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Redaktørene av Enyclopaedia Britannica. (27. november 2018). Hydrogenperoksyd. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- New Jersey Department of Health. (2016). Hydrogenperoksyd. [PDF]. Gjenopprettet fra: NJ.Gov
- Mathews, c. K., Van Holde, K. OG., Ahern, k. G. (2002). Biokjemi. Tredje utgave. Pearson Addison Wesley redaksjon
- MD Web. (2019). Hydrogenperoksyd. Hentet fra: WebMD.com
- « Aztekisk medisinhistorie, Gud, planter, sykdommer
- Sinkoksid (ZnO) struktur, egenskaper, bruksområder, risikoer »

