Pyruvat kinasestruktur, funksjon, regulering, hemming
- 2384
- 342
- Magnus Sander Berntsen
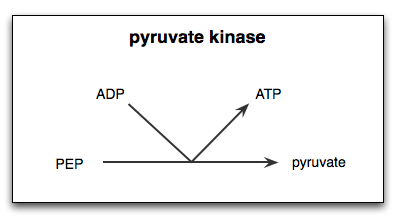
 Reaksjon katalysert av enzymet pyruvato kinase
Reaksjon katalysert av enzymet pyruvato kinase Hva er kinase -pyruvatet?
De Pyruvat kinase (Pyk) Det er enzymet som katalyserer det siste trinnet i den glykolytiske ruten, noe som innebærer den irreversible overføringen av fosfatgruppen til et fosfoenolpiruvat (PEP) molekyl mot et ADP -molekyl, noe Pyruvate.
Pyruvatet som produseres senere deltar i forskjellige katabolske og anabole (biosyntetiske) ruter: det kan dekarboksyleres for å produsere acetyl-CoA, karboksylert for å produsere oksalacetat, transaminert for å produsere alanin, oksidert for å produsere laktisk syre eller kan være rettet mot glukoneogenese for syntese av syntese av syntese av laktinsyre glukose.
Siden den deltar i glykolyse, er dette enzymet av største betydning for karbohydratmetabolisme av mange organismer, encellulær og flercellulær, som bruker dette som den viktigste katabolske ruten for å oppnå energi.
Et eksempel på strengt avhengige celler av glykolyse for å oppnå energi er det av pattedyr erytrocytter, som en mangel i noen av enzymer som deltar i denne ruten kan ha betydelig negative effekter.
Pyruvat kinasestruktur
Hos pattedyr er fire isoformer av enzymet pyruvatkinase blitt beskrevet:
- PKM1, Typisk i muskler
- PKM2, Bare i fostre (begge produktene fra alternativ behandling av samme messenger -RNA)
- Pkl, til stede i leveren og
- PKR, til stede i erytrocytter (begge kodet av det samme genet, Pklr, men transkribert av forskjellige promotører).
Imidlertid viser analysen utført til strukturen til de forskjellige enzymene pyruvatkinase i naturen (inkludert disse 4 av pattedyrene) en stor likhet i den generelle strukturen, så vel som med hensyn til arkitekturen til det aktive stedet og reguleringsmekanismene.
Kan tjene deg: koloniale assosiasjoner: Kjennetegn, typer og eksemplerGenerelt er det et enzym med 200 kDa molekylvekt, preget av en tetramerisk struktur sammensatt av 4 identiske proteinenheter, mer eller mindre 50 eller 60 kDa, og hver med 4 domener, nemlig:
- Et domene spiralformet liten ved N-terminal enden (fraværende i bakterieenzymer)
- Et domene "TIL”, Identifisert ved en topologi av 8 brett β -skiver og 8 hall α
- Et domene "B”, Satt inn mellom det brettede beta -lamina nummer 3 og alfa -domenet“ A ”domene -domene
- Et domene "C”, Som har en α+β -topologi
 Molekylær struktur av enzymet pyruvatkinase
Molekylær struktur av enzymet pyruvatkinase Tre steder er blitt påvist i tetramerne av kinase -pyruvatet til forskjellige organismer: det aktive stedet, effektorstedet og aminosyrebindingsstedet. Det aktive stedet for disse enzymene er mellom domenene A og B, nær "effektorstedet", som tilhører domene C.
I Tetrámero danner D -domener et "lite" grensesnitt, mens domener i form av et større grensesnitt.
Funksjon av kinase pyruvat
Som allerede nevnt, katalyserer kinase -pyruvatet det siste trinnet i den glykolytiske ruten, det vil si overføring av en fosfatgruppe fra fosfoenolpirruvat (PEP) til et ADP -molekyl for å produsere en ATP og et pyruvat eller pyruvinsyre.
Produktene fra reaksjonen katalysert av dette enzymet er av største betydning for forskjellige metabolske kontekster. Pyruvat kan brukes på forskjellige måter:
- Under aerobe forhold, det vil si i nærvær av oksygen, kan dette brukes som et underlag av et enzym kjent som den gratis dehydrogenase-pyruvat, for å bli dekarboksylert og omgjort til acetyl-CoA, et molekyl som kan komme inn i Krebs-syklusen i mitokondria eller delta i andre anabole ruter som for eksempel fettsyrebiosyntese.
- I fravær av oksygen eller anaerobiose, kan pyruvat brukes av enzymet laktatdehydrogenase for å produsere melkesyre (oksidasjon) gjennom en prosess kjent som "melkegjæring" ".
- I tillegg kan pyruvat omdannes til glukose gjennom glukoneogenese, til alanin ved transaminase alanin, i oksalacetat ved karboksylase -pyruvat, etc.
Det er viktig å huske at i reaksjonen katalysert av dette enzymet, forekommer nettsyntesen av ATP som telles for glykolyse, produserer av hvert glukosemolekyl 2 pyruvatmolekyler og 2 ATP.
Fra dette perspektivet har enzymkinase -pyruvat en grunnleggende rolle i mange aspekter av cellulær metabolisme, så mye, som brukes som terapeutisk mål for mange patogener av mennesket, blant dem forskjellige protozoer skiller seg ut.
Regulering
Kinase -pyruvatet er et ekstremt viktig enzym fra cellemetabolismen, ettersom det er den som danner den siste forbindelsen som følge av katabolisme -ruten til glukose: pyruvat.
I tillegg til å være en av de tre mest regulerte enzymene i hele glykolytisk rute (de to andre heksokinase (HK) og fosfofrucerachinase (PFK)), er kinase -pyruvatet et veldig viktig enzym for kontroll av metabolsk strøm og produksjon av ATP gjennom glykolyse.
Det aktiveres av fosfoenolPiruvat, et av underlagene (homotropisk regulering), så vel som av andre mono- og diposforylerte sukkerarter, selv om dens regulering avhenger av typen isoenzym som blir vurdert.
Noen vitenskapelige tekster antyder at reguleringen av dette enzymet også avhenger av dens "multidominium" -arkitektur, siden aktiveringen ser ut til å avhenge av noen rotasjoner i domenene til underenhetene og endringer i geometrien til det aktive stedet.
For mange organismer avhenger den Árosteriske aktiveringen av kinase-pyruvatet av fruktose 1,6-bifosfat (F16bp), men dette er ikke sant for grønnsaksenzymer. Andre enzymer aktiveres også av syklisk AMP og glukose 6-fosfat.
Kan tjene deg: Hender: Kjennetegn, struktur, funksjonerI tillegg er det vist at aktiviteten til de fleste av pyruvatkinaser som er studert, avhenger sterkt av tilstedeværelsen av monovalente ioner som kalium (K+) og divalente ioner som magnesium (Mg+2) og mangan (MN+2).
Hemming
Kinase -pyruvatet blir hovedsakelig hemmet av fysiologisk effektor, så disse prosessene varierer betydelig mellom forskjellige arter og til og med mellom celler og vev i samme organisme.
Hos mange pattedyr har glukagon, epinefrin og AMPC hemmende effekter på kinase -pyruvataktiviteten, effekter som kan motvirkes ved insulin.
I tillegg har det blitt bevist at noen aminosyrer som fenylalanin kan ha handlinger som konkurrerende hemmere for dette enzymet i hjernen.

