Polaritet (kjemi) Hva er definisjon, eksempler
- 4069
- 516
- Mathias Aas
Hva er kjemisk polaritet?
De Kjemisk polaritet Det er en egenskap som er preget av tilstedeværelsen av en markert heterogen fordeling av elektroniske tettheter i et molekyl. I sin struktur er det derfor negativt belastede regioner (Δ-), og andre positivt ladet (δ+), og genererer et dipolmoment.
Dipolmomentet (µ) av kobling er en form for uttrykk for polariteten til et molekyl. Den er vanligvis representert som en vektor hvis opprinnelse er i belastningen (+) og enden er plassert i belastningen (-), selv om noen kjemikalier representerer den omvendt.
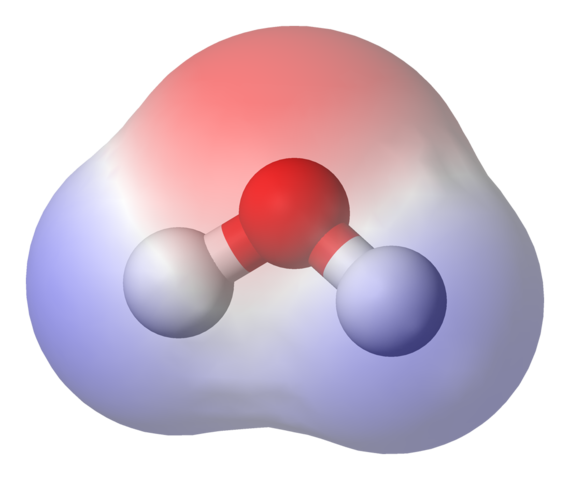
 Elektrostatisk potensiell kart for vannmolekylet. Kilde: Benjah-BMM27 via Wikipedia.
Elektrostatisk potensiell kart for vannmolekylet. Kilde: Benjah-BMM27 via Wikipedia. I det øvre bildet vises det elektrostatiske potensielle kartet for vann, h2ENTEN. Det rødlige området (oksygenatom) tilsvarer det med den høyeste elektroniske tettheten, og det kan også sees at den skiller seg ut på de blå områdene (hydrogenatomer).
Ettersom fordelingen av nevnte elektronisk tetthet er heterogen, sies det at det er en positiv og en negativ pol. Det er grunnen til at vi snakker om kjemisk 'polaritet, og for øyeblikket dipol.
Dipolar øyeblikk
Dipolmomentet µ er definert av følgende ligning:
µ = Δ ·d
Hvor Δ er elektrisk ladning for hver pol, positiv (+Δ) eller negativ (-Δ), og d Det er avstanden mellom dem.
Dipolmomentet uttrykkes vanligvis i Debye, representert av symbolet D. En Coulomb · Metro tilsvarer 2 998 · 1029 D.
Verdien av dipolmomentet til koblingen mellom to forskjellige atomer er i forhold til forskjellen i elektronegativiteter til atomene som danner lenken.
For at et molekyl skal være polar, er det ikke nok å ha polare koblinger i strukturen, men også må ha asymmetrisk geometri; På en slik måte forhindrer det dipolmomentene i å annullere hverandre.
Kan tjene deg: Karbonoider: Elementer, egenskaper og brukAsymmetri i vannmolekylet
Vannmolekylet har to O-H-bindinger. Geometrien til molekylet er kantete, det vil si med form av "V"; Så dipolmomentene til koblingene avbryter ikke hverandre, men summen av dem oppstår ved å peke mot oksygenatom.
Det elektrostatiske potensielle kartet for h2Eller reflektere dette.
Hvis H-O-H-vinkelmolekylet blir observert, kan følgende spørsmål oppstå: er det virkelig asymmetrisk? Hvis det trekkes en tenkt akse som krysser oksygenatomet, vil molekylet bli delt i to like halvdeler: H-o | O-H.
Men det er ikke slik hvis den imaginære aksen er horisontal. Når denne aksen nå deler molekylet igjen i to halvdeler, vil oksygenatom være på den ene siden, og på den andre de to hydrogenatomene.
Dette er grunnen til at den tilsynelatende symmetrien til H2Eller slutter å eksistere, og derfor vurderes et asymmetrisk molekyl.
Polare molekyler
Polare molekyler må oppfylle en serie egenskaper, for eksempel:
-Distribusjon av elektriske ladninger i molekylstrukturen er asymmetrisk.
-De er vanligvis oppløselige i vann. Dette skyldes mellom polare molekyler kan samhandle av dipol-dipolo-krefter, der vann er preget av å ha et stort dipolmoment.
I tillegg er den dielektriske konstanten veldig høy (78,5), som lar deg opprettholde separate elektriske belastninger som øker løseligheten.
-Generelt sett har polare molekyler høye kokende og fusjonspunkter.
Disse kreftene er sammensatt av Dipolo-Dipolo-interaksjonen, de spredende kreftene i London og dannelsen av hydrogenbroer.
Kan tjene deg: jernsulfat (FESO4): Hva er, struktur, egenskaper, syntese-På grunn av den elektriske ladningen, kan polare molekyler drive strøm.
Eksempler
SW2
Svoveldioksid (så2). Oksygen har en elektronegativitet på 3,44, mens svovelelektronegativitet er 2,58. Derfor er oksygen mer elektronegativ enn svovel. Det er to koblinger s = o, med eller en belastning Δ- og s en belastning Δ+.
Fordi det er et vinkelmolekyl med S i toppunktet, er de to dipolmomentene orientert i samme retning; Og derfor legger de opp, gjør det molekylet2 være polar.
CHCL3
Kloroform (HCCl3). Det er en C-H-kobling og tre C-CL-koblinger.
Elektronegativiteten til C er 2,55, og elektronegativiteten til H er 2,2. Dermed er karbon mer elektronegativ enn hydrogen; Og derfor vil dipolmomentet være orientert fra H (Δ+) til C (Δ-): CΔ--HΔ+.
Når det gjelder C-CL-koblinger, har C en elektronegativitet på 2,55, mens CL har en elektronegativitet på 3,16. Dipol- eller dipolmomentet er orientert fra C til CL i de tre C -koblingene Δ+-Cl Δ-.
Når det er et dårlig område med elektroner, rundt hydrogenatom og et område rikt på elektroner som består av de tre kloratomene, CHCL3 Det regnes som et polært molekyl.
Hf
Hydrogenfluorid har bare en H-F-binding. Elektronegativiteten til H er 2,22 og elektronegativiteten til F er 3,98. Derfor ender fluor med den største elektroniske tettheten, og koblingen mellom begge atomene beskrives best som: hΔ+-FΔ-.
Kan tjene deg: Aluminiumhydroksyd: Struktur, egenskaper, bruksområder, risikoerNH3
Ammoniakk (NH3) har tre N-H-koblinger. Elektronegativiteten til N er 3,06 og elektronegativiteten til H er 2,22. I de tre bindingene er elektronisk tetthet orientert mot nitrogen, og blir enda større av tilstedeværelsen av et par frie elektroner.
NH -molekylet3 Det er tetraedralt, med atomet som okkuperer toppunktet. De tre dipolmomentene, tilsvarende N-H-koblingene, er orientert i samme retning. I dem er Δ- lokalisert i n og Δ+ i h. Dermed er koblingene: nΔ--HΔ+.
Disse dipolmomentene, asymmetrien til molekylet og elektron -frie dreiemoment på nitrogen, gjør ammoniakk til et sterkt polært molekyl.
Makromolekyler med heteroátomos
Når molekylene er veldig store, er det ikke lenger nøyaktig å klassifisere dem som apolar eller polare i seg selv. Dette er fordi det kan være deler av dens struktur med begge apolare (hydrofobe), for eksempel polare (hydrofile) egenskaper.
Disse typer forbindelser er kjent som amfifiloer eller amfipatisk. Fordi den apolare delen kan betraktes som dårlig i elektroner med hensyn til den polare delen, er det en polaritet til stede i strukturen, og amfiprylforbindelser blir betraktet som polare forbindelser.
Det kan forventes generelt at et makromolekyl med heteroatomer har dipolmomenter, og med det, kjemisk polaritet.
Heteroátomos forstås av de som er forskjellige fra de som utgjør skjelettet til strukturen. For eksempel er karbonatisert skjelett biologisk det viktigste av alle, og atomet som karbon (i tillegg til hydrogen) koblinger, kalles det heteroátomo.
Referanser
- Polare og ikke -polare forbindelser. St. Louis Community College. Gjenopprettet fra: Brukere.STLCC.Edu
- Hvordan forklare polaritet. Scienting. Gjenopprettet fra: Scienting.com

