Porinas egenskaper, funksjon og montering
- 2485
- 50
- Mathias Aas
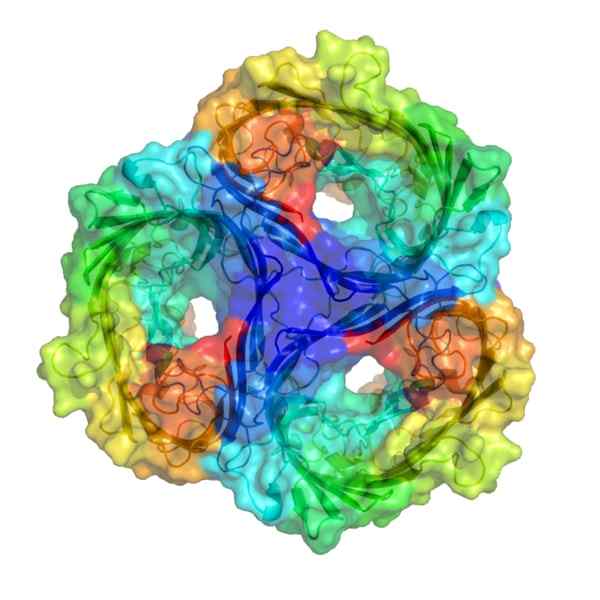
De Porinas De er en type omfattende membranprotein som tillater formidling av forskjellige typer middels størrelse molekyler. De finnes i de ytre membranene av gram -negative bakterier (som i OG. coli) og mitokondrier og kloroplaster. Disse transmembranale proteinene overfører membranene fullstendig, og strukturen deres dannes av β -ark fullstendig.
I motsetning til transportbåndproteiner, er poriner kanalproteiner, det vil si at de danner kanaler eller åpne porer som krysser membranen der den ligger, slik at den frie diffusjonen av molekyler med passende størrelse og belastning.
 Kilde: I: Bruker: Zephyris [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]
Kilde: I: Bruker: Zephyris [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]] [TOC]
Kjennetegn
Porinas er proteiner som lager transmembraalkanaler, og i motsetning til de fleste proteiner som krysser en membran, utgjør delen som krysser denne membranen av β -ark i stedet for α propell.
Disse omfattende membranproteinene kan mangle en selektivitet med hensyn til molekylene som vil passere gjennom dem, eller kan presentere visse grader av størrelse og belastningsselektivitet. De kan også tillate passering av molekyler mindre enn en viss størrelse.
Den polare regionen av porinkjeden er inne som dekker den vandige kanalen, mens den apolare delen er projisert utenfor tønnen, og samhandler med det hydrofobe området til lipid -dobbeltlaget i membranen.
Diffusjonen gjennom kanalene dannet av disse proteinene skyldes en konsentrasjonsgradient av molekylet eller stoffet som krysser membranen og er en passiv diffusjon, det vil si at den ikke krever metabolsk energi for bevegelse av stoffet.
Denne diffusjonen styres av spesifikke mekanismer som kan åpne eller lukke kanalen og kan hemmeres av flere forbindelser.
Kan tjene deg: Cytotrophoblast: Kjennetegn, utvikling og funksjonStruktur
På slutten av 1980 -tallet, gjennom x -råkrystallografi, ble atomstrukturen til en porina bestemt for første gang, tilsvarende cellemembranen til Rhodobacter Capsulatus som er en fotosyntetisk bakterie.
Denne porinaen består av en trimmer, der hver monomer danner en ß -fat med 16 β -ark som rulles sammen, og danner en sylindrisk struktur som er i stand til å krysse membranen og som inneholder en pore full av vann inni.
Ulike typer poriner er beskrevet siden den gang, både prokaryote og eukaryote celler. Alle av dem består av koblede β -ark som danner en ß -tønne struktur og et vann fullt av vann som kan måle mellom 0,6 til 3nm i diameter.
I mitokondriene består porinene av 19 β -ark som brettet hverandre β -fatet.
I mange bakterier er porinene sammensatt av mellom 16 og 18 anti-parallelle β-ark som danner en ß-tønne, og presenterer hydrogenbindinger mellom de nærliggende molekylene langs kjeden.
Funksjon
Porinene til bakteriene og membranene til mitokondrier og kloroplaster er funksjonelt like, og opererer på en lignende måte, på grunn av dens likhet med tanke på dimensjonene til porene, atomstruktur og passive diffusjonsegenskaper.
Bredden på porinkanalen er definert av justeringen av polypeptider i den indre veggen i strukturen, slik at de kan begrense størrelsen på molekylene som vil passere gjennom dem.
Likheten mellom disse strukturene forsterker endosimbiotisk teori, hvor mitokondriene til eukaryotiske celler kommer fra en prokariotisk organisme som ble fagocied av en forløper til den eukaryote cellen.
Det kan tjene deg: Tone: Kjennetegn og funksjonerI eukaryoter
I eukaryote celler finnes de i de ytre membranene i mitokondrier og plastider. Porinas funnet i plasten har blitt veldig lite studert.
Når det gjelder mitokondrier er de kjent som mitokondrielle poriner eller spenning -avhengige anioniske kanaler (VDAC). De er brede kanaler med en omtrentlig diameter på 3nm som utgjør den største proteinbestanddelen i ytre membraner. De representerer omtrent 30% av det totale proteinet i denne membranen.
Generere permeabilitet for molekyler uten belastning på opptil 5000 DA. Mitokondrielle poriner tillater passering mot intermembranområdet til små molekyler, ioner og metabolitter.
Molekylene og ionene som krysser intermembranalt rom, passerer ikke gjennom den indre mitokondrielle membranen, siden den har større impermeabilitet. Derfor er rommet mellom de to membranene lastet med små molekyler og ioner, og er lik cytoplasma.
I prokaryoter
I gram -negative bakterier lar en ekstern membran å isolere seg fra miljøet som et beskyttelsesmål. Denne membranen inneholder permeabel for næringsstoffene som kakterier kreves.
Du kan finne omtrent 100.000 porinas i membranen til en prokaryotisk celle, som representerer omtrent 70% av de totale proteinene i den strukturen.
I tarmbakterier representerer den ytre membranen beskyttelse mot ytre skadelige midler som antibiotika, gallesalter og proteaser.
Poriner sikrer fangst og eliminering av små hydrofile molekyler, og lar dermed cellen oppnå næringsstoffer som er nødvendige for riktig funksjon og kan frigjøres fra avfallsprodukter. I OG. coli, Porinas tillater passering av disakkarider, fosfater og andre små molekyler.
Montering av porinas i eukaryoter og prokaryoter
Mitokondrielle poriner importeres til mitokondrier av et proteinkompleks kalt TOM (ekstern mitokondriell membrantranslokase) og settes inn av SAM -komplekset (klassifiseringsmaskineri og proteinmontering).
Kan tjene deg: hvor mange celler har menneskekroppen?Mange studier har beskrevet som noen eksterne membranproteiner av bakterier importeres til eukaryote cellemitokondrier av en mekanisme som administreres av TOM- og SAM -komplekser, noe som indikerer at denne innsettingsprosessen er bevart mellom de to systemene.
I bakterier settes poriner inn av et kompleks som har monteringsmaskineriet til β -fat som kalles BAM. Dette komplekset består av fem proteiner, hvorav fire er lipoproteiner.
Selv om prosessen med innsetting av poriner og deres strukturer er lik mellom eukaryote celler og prokaryoter, er en bemerkelsesverdig forskjell at i prokaryoter er det nødvendig med å sette inn disse strukturer tilstedeværelsen av lipoproteiner.
På den annen side avhenger monteringen i mitokondrielle ytre membraner av tilstedeværelsen av to tilbehørsproteiner i SAM -komplekset: SAM35 og SAM36 -proteiner.
Referanser
- Alberts, f., Bray, d., Watson, J. D., Lewis, J., Roberts, k. & Raff, m. (2002). Biologi av cellemolekylæren. Fjerde utgave. Ed. Garland Science.
- Devlin, m. T. (1993). Texbook of Biochemistry med kjemiske korrelasjoner. Ed. John Wiley & Sons, Inc.
- Lodish, h. (2005). Cellulær og molekylær biologi. Ed. Pan -American Medical.
- Schirmer, t., & Rosenbusch, J. P. (1991). Prokaryotiske og eukaryote byiner. Nåværende mening i strukturell biologi, 1 (4), 539-545.
- Schulz, g. OG. (1993). Bakterielle byiner: struktur og funksjon. Nåværende mening i strukturell biologi, 5 (4), 701-707.
- Voet, d., & Voet, j. G. (2006). Biokjemi. Ed. Pan -American Medical.
- Zeth, k., & Thein, m. (2010). Byins i prokaryoter og eukaryoter: vanlige temaer og variasjoner. Journal Biochemical, 431 (1), 13-22.

