Le Châtelier -prinsippet

- 5007
- 1062
- Jonathan Carlsen
Hva er Le Châteliers prinsipp?
Han Le Châtelier -prinsippet Det er en generell regel som forutsier effekten at de forskjellige faktorene som påvirker den kjemiske balansen har. Spesielt hjelper det å forutsi i hvilken retning en reaksjon som er i balanse vil bevege seg når en slik balanse forstyrres av et eksternt middel.
Dette prinsippet fastslår at:
"Når et system som er i likevekt er underlagt en forstyrrelse eller en ytre spenning, reagerer systemet i retningen som lar det delvis motvirke slik forstyrrelse".
Forstyrrelse er godt forstått:
- En endring i konsentrasjonen av noen av reagensene.
- En endring i konsentrasjonen av noen av produktene.
- Endringer i trykk.
- Endringer i volum.
- En temperaturendring
Når endringer skjer som de som er nevnt, er den ene av de to reaksjonene, den direkte eller den inverse, foretrukket med hensyn til den andre, slik at systemet reagerer i den forstand beveger seg mot en ny likevekt tilstand.
Dette ligner på justeringene som er gjort av en balanse på strammen. Når tyngdekraften Hala på den ene siden, reagerer balansen ved å bevege seg til motsatt side. Vi sier at balansen hans beveget seg, siden han fremdeles er i balanse (han faller ikke), men nå har han en annen posisjon.
Deretter vil vi se hvordan Le Châtelier -prinsippet brukes til å forutsi retningen et system vil reagere ved å lide forskjellige typer spenninger eller forstyrrelser som: endringer i konsentrasjon, volum, trykk og temperatur.
Effekt av endringer i konsentrasjonen
Anta at vi har følgende reaksjon i balanse:
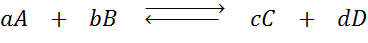
Hvis vi endrer konsentrasjonen av noen av artene som er involvert (A, B, C eller D), spår prinsippet om Le Châtelier at systemet vil reagere for å motvirke denne endringen, enten å konsumere overskuddet tilsatt eller gjenopprette den eliminerte mengden. 4 forskjellige situasjoner kan gis:
1. Økt konsentrasjon av reagenser
Hvis vi øker konsentrasjonen av et reagens, for eksempel, i henhold til prinsippet til Le Châtelier, vil systemet reagere for å konsumere det ekstra overskuddet. Dette betyr at den vil reagere direkte (fra venstre mot høyre), siden denne retningen konsumeres til.
I dette tilfellet sies det at den direkte reaksjonen er foretrukket og at balansen beveget seg mot produktene, siden konsentrasjonen av produkter i den nye balansen er større enn i den opprinnelige balansen.
Kan tjene deg: magnetisk separasjon2. Økt konsentrasjon av produkter
Hvis vi øker konsentrasjonen av et produkt, for eksempel C, vil systemet reagere i revers for å konsumere overskuddet C lagt til (det vil si fra høyre til venstre).
I dette tilfellet sies det at den omvendte reaksjonen er foretrukket og at balansen beveger seg mot reagensene.
3. Reduksjon i reagenskonsentrasjon
Nedgangen i konsentrasjonen har den motsatte effekten av økningen i nevnte konsentrasjon. Hvis vi trekker oss fra mediet, og dermed reduserer konsentrasjonen, vil systemet reagere på venstre (omvendt) for å motvirke endringen. Balansen beveger seg mot reagensene.
4. Reduksjon i produktens konsentrasjon
Hvis vi reduserer konsentrasjonen av C eller D, vil systemet reagere direkte for å erstatte den reduserte konsentrasjonen (det vil si fra venstre mot høyre). Balansen beveger seg mot produktene.
Eksempel:
Bestem effekten av å legge til flere tiocianate -ioner (SCN-) I følgende kjemiske balanse er det gult å vite at produktet av høyre er intens rødt og jern (III).
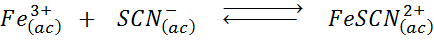
Løsning: I dette tilfellet legger vi til Tiocianato som er et reagens, så balansen må bevege seg til høyre og øke konsentrasjonen av komplekset og derfor intensiteten til den røde fargen i løsningen.
Effekt av endringer i volum og trykk
Endringer i volum og trykk påvirker ikke reaksjoner i likevekt i flytende eller fast tilstand, men de kan påvirke de som finnes i en gassformig tilstand. Dette er fordi konsentrasjonen for gasser er proporsjonal med trykket, som forutsagt av Ideal Gases -loven.
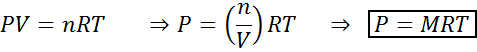
Å øke trykket på en gass som opprettholder den konstante temperaturen tilsvarer å redusere volumet, så effekten av begge forstyrrelsene vil være den samme.
Hvis et totalt trykk øker til en balansereaksjon i likevekt (eller vi reduserer volumet), vil systemet reagere for å prøve å redusere et slikt trykk igjen, så balansen vil bevege seg dit det er en mindre mengde gassformede partikler molekyler.
Kan tjene deg: Fin lagkromatografi: egenskaper, hva er det for I reaksjonen mellom nitrogen og hydrogen for å danne ammoniakk, konsumeres 4 brusmolekyler og bare to produseres, så en økning i trykk fortrenger balansen mot den mest ammoniakkdannelsen
I reaksjonen mellom nitrogen og hydrogen for å danne ammoniakk, konsumeres 4 brusmolekyler og bare to produseres, så en økning i trykk fortrenger balansen mot den mest ammoniakkdannelsen Hvis de i reaksjonen blir konsumert og det samme antallet gassmolekyler produseres, vil ikke volum og trykkendringer påvirke balansen.
På den annen side, hvis vi bare modifiserer delvis trykket til noen av gassene, er effekten den samme som å øke eller redusere konsentrasjonen av nevnte arter.
Eksempel:
Gitt nedbrytningsreaksjonen av dyitrogentroksyd i balanse:
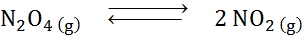
Bestem effekten av å redusere volumet, øke trykket.
Løsning: Hvis vi øker det totale systemtrykket eller reduserer volumet, beveger balansen seg mot reagensene, siden det i den retningen er en netto reduksjon i gassmolekyler (2 og 1) konsumeres 1) som gjør det mulig å motvirke økningen i trykk.
Effekt av temperaturendringer
Effekten av temperatur på kjemisk balanse er forskjellig fra de andre faktorene som vi har sett så langt. I de tidligere tilfellene oppnås en ny balanse etter forstyrrelsen, men den samme likevektskonstanten opprettholdes. Imidlertid, hvis temperaturen endres, vil likevektskonstanten endres.
For å vite hvordan likevektskonstanten endres med temperatur, må reaksjonsentalpienes tegning være kjent:
- Hvis en reaksjon frigjør varme, det vil si den er eksotermisk, er entalpien negativ, og likevektskonstanten avtar når temperaturen øker. I disse tilfellene beveger balansen i motsatt retning mot reagensene.
- Hvis en reaksjon absorberer varme, det vil si den er endotermisk, er entalpien positiv og det motsatte skjer.
Å huske effekten av temperaturen er enkel hvis vi anser varme som et reagens som oppstår i tilfelle av eksotermiske reaksjoner og konsumeres i tilfelle endotermisk. Økende temperatur vil være som "tilsett" varme til systemet og avkjøle dem vil være likeverdig for å fjerne det.
Så hvis en reaksjon er eksoterm og temperaturen økes, vil det være som å legge til et produkt av reaksjonen, så balansen beveger seg i motsatt retning, mot reagensene, og hvis den kjøler det motsatte.
Det kan tjene deg: Píchric Acid: Hva er, struktur, syntese, egenskaperPå den annen side, hvis en reaksjon er endoterm og temperaturen økes, vil det være som å legge til et reagens, så balansen beveger seg mot produktene, mens en nedgang i temperaturen har motsatt effekt.
Eksempel:
Nedbrytningsreaksjonen til n2ENTEN4 Den har en +58,0 kJ/mol reaksjon entalpi. I hvilken retning balansen vil bevege seg hvis temperaturen reduseres?
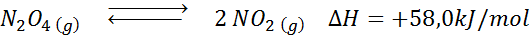
Løsning: Siden entalpi er positiv, er reaksjonen endotermisk. Av denne grunn vil avkjøling av det favorisere den omvendte reaksjonen, og balansen vil bevege seg mot reagensene, det vil si mot dannelsen av mer n2ENTEN4.
Effekt av katalysatorer, hemmere og inerte stoffer
Katalysatorer og hemmere påvirker hastigheten som reaksjoner oppstår, men de påvirker både direkte og indirekte reaksjon. Av denne grunn påvirker de ikke likevektstilstanden.
På den annen side vil tilsetning av et inert stoff som en gass som ikke reagerer med noen av reagensene eller produktene, ikke påvirke direkte eller direkte reaksjon, så det vil ha noen innvirkning på balansen.
Anvendelse av Le Châteliers prinsipp
Å forstå dette prinsippet er veldig nyttig, siden det lar oss manipulere tilstanden til balansen i en reaksjon på vår bekvemmelighet.
I de tilfellene er vi interessert i.
Dette betyr:
- Legg til store mengder reagenser, hvis disse er økonomiske.
- Trekke produktet etter hvert som reaksjonen skrider frem, for å opprettholde systemet i konstant spenningstilstand, og prøver alltid å oppnå balanse som reagerer direkte.
- Øk temperaturen i tilfelle endotermiske reaksjoner.
- Øke trykket på reaksjonene der flere gassmolekyler forbrukes enn de oppstår.
Det kan også være lurt å minimere mengden av et produkt som dannes ved en uønsket reaksjon. I disse tilfellene gjør vi det motsatte.
Søknadseksempel på Le Châtelier -prinsippet
I organisk syntese brukes prinsippet om Le Châtelier stadig for å forbedre reaksjonsutbytter.
For eksempel ved alkohol dehydreringsreaksjoner blir tørkemidler tilsatt miljøet som absorberer vannet som ble dannet under reaksjonen. Dette reduserer konsentrasjonen av nevnte produkt, som fortrenger balansen mot produktene.

