Adiabatiske prosesstyper, eksempler, øvelser løst
- 5043
- 126
- Jonathan Carlsen
EN Adiabatisk prosess Det er den der det ikke er noen varmeutveksling mellom systemet og omgivelsene, verken fordi det oppstår i et isolerende medium, eller fordi det går veldig raskt. Dette betyr at i omgivelsene i systemet er dette, den delen av universet som studeres, bør temperaturendringer ikke oppfattes, men bare arbeid.
Dette er en av de elementære prosessene med termodynamikk. I motsetning til de andre prosessene (isokorisk, isobarisk og isotermisk), forblir ingen av dens fysiske variabler konstant; Det vil si at størrelsene på trykk, volum, temperatur og entropi endres når den adiabatiske prosessen utvikler seg.
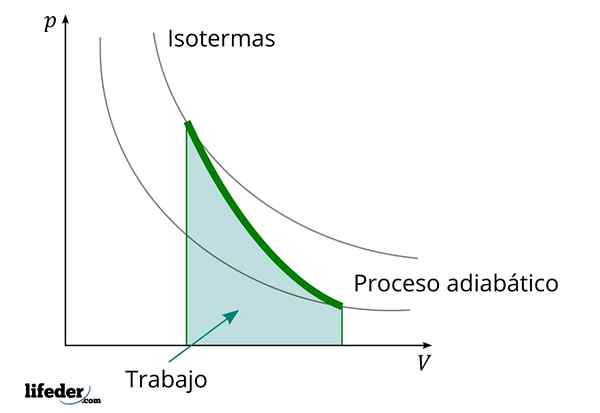
 Under en adiabatisk prosess der volumet øker, er den indre energien i stoffet som arbeidet reduseres
Under en adiabatisk prosess der volumet øker, er den indre energien i stoffet som arbeidet reduseres Et annet viktig kjennetegn ved de adiabatiske prosessene er at de utfører eller bruker arbeid proporsjonalt med variasjonen av den interne energien i deres systemer; I dette tilfellet av de av molekylene i en gassfase. Dette kan demonstreres takket være den første loven om termodynamikk.
I dagliglivet dekker denne typen prosesser fremfor alt til geofysiske fenomener og til en viss grad funksjonen av stempler i dieselmotorene. Varmeoverføring forhindres ofte ved bruk av et isolasjonsmedium, men det er hastigheten på disse prosessene som tillater deres virkelige utvikling.
[TOC]
Reversible og irreversible adiabatiske prosesser
Reversibel
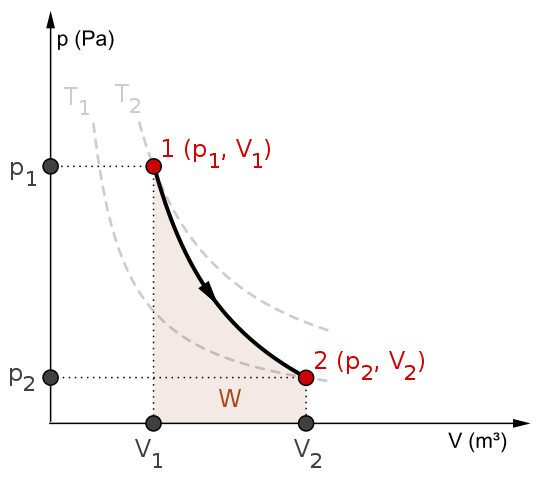 P-V-diagram og arbeid w for en adiabatisk prosess. Kilde: Mikerun/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)
P-V-diagram og arbeid w for en adiabatisk prosess. Kilde: Mikerun/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0) Adiabatiske prosesser kan være reversible eller irreversible. Førstnevnte eksisterer imidlertid bare som teoretiske verktøy for å studere sistnevnte. Dermed involverer de reversible adiabatiske prosessene de ideelle gassene, og mangler friksjon og all annen eventualitet som forårsaker en varmeoverføring mellom systemet og omgivelsene.
Tenk for eksempel P-V-diagrammet for den reversible adiabatiske prosessen ovenfra. T1 og T2 samsvarer med to isotermer, som presset P og volumene V av systemet varierer.
Blant statene (P1, V1) Og s2, V2) En reversibel adiabatisk utvidelse utføres, siden vi beveger oss fra et bind V1 til en v2, større, etter pilens retning.
Ved å gjøre dette avkjøles systemet, men uten å adlyde atferden til isotermer. Området under kurven tilsvarer arbeidet W, hvis verdi er positivt fordi det er en utvidelse.
I denne prosessen forblir entropien konstant, og derfor sies det at den er isontropisk. Den matematiske behandlingen av denne reversibiliteten genererer et sett med ligninger som det er mulig å evaluere andre systemer.
Kan tjene deg: elektrolytiske cellerIrreversibel
Irreversible adiabatiske prosesser, i motsetning til de reversible, er ikke grafiske i P-V-diagrammer med kontinuerlige, men prikkede linjer, siden bare de endelige og innledende tilstandene har sine variabler (p, v og t) godt definert. Disse prosessene involverer reelle gasser, så ligningen av ideelle gasser og deres avledninger er ikke direkte anvendelige for dem.
De passerer raskt og forhindrer varmeoverføring mellom systemet og omgivelsene. I dem øker også entropi, som det fremgår av termodynamikkens andre lov.
Eksempler på adiabatiske prosesser
 Isolasjonskapasiteten, slik som den presenteres av Thermos, er en av nøkkelfaktorene for en prosess for å utvikle adiabatisk
Isolasjonskapasiteten, slik som den presenteres av Thermos, er en av nøkkelfaktorene for en prosess for å utvikle adiabatisk Noen eksempler på adiabatiske prosesser vil bli nevnt nedenfor.
Utvidelse og forståelse
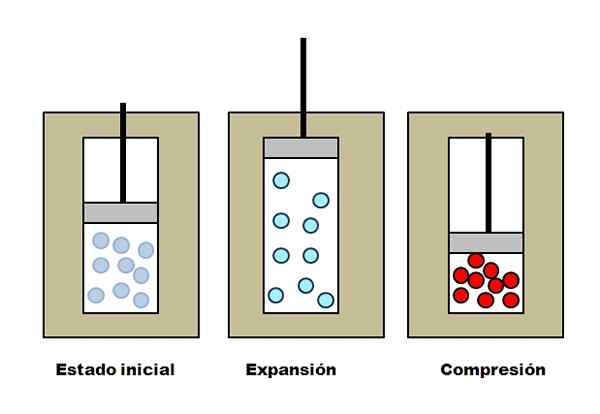 Adiabatisk ekspansjon og forståelse. Kilde: Gabriel Bolívar.
Adiabatisk ekspansjon og forståelse. Kilde: Gabriel Bolívar. Anta at tre isolerende vester inneholder rom full med gass. I en innledende tilstand har stempelet ikke noe trykk på gass. Deretter får stempelet lov til å stige, noe som øker volumet som gassmolekylene kan bevege seg, noe som forårsaker en reduksjon i dens indre energi; Og derfor en nedgang i temperaturen.
Det motsatte skjer med adiabatisk komprimering: Stempelet utfører arbeid med gass, og reduserer volumet som molekylene kan okkupere. Intern energi øker denne gangen, noe som også innebærer en temperaturøkning, hvis varme ikke kan spre seg mot omgivelsene på grunn av den isolerende vesten.
Magma Ascent
Kanalene der magma stiger inne i en vulkan som forteller som et isolerende medium, som forhindrer varmeoverføring mellom magma og atmosfære.
Lydspredning
Gassene blir forstyrret og utvides i henhold til lydbølgen uten avkjøling eller varm luften som omgir dem.
Foehn -effekt
Foehn -effekten er et eksempel på adiabatiske prosesser innen geofysikk. Luftmassene stiger opp mot den øvre delen av et fjell der de opplever mindre trykk, så molekylene deres utvides og kjøler seg, og gir opphav til dannelsen av skyen.
Imidlertid går de knapt ned på den andre siden av fjellet, trykket øker, og derfor komprimeres molekylene og løfter temperaturen, noe som får skyen til å forsvinne.
Kan tjene deg: Chlorbenzen (C6H5CL)I den følgende videoen kan dette fenomenet bli verdsatt:
Løste øvelser
Endelig vil et par øvelser bli løst. Det er viktig å ha følgende ligninger for hånden:
ΔU = Q - W (Første lov om termodynamikk)
Men har ingen varmeoverføring, q = 0 y:
ΔU = - W (1)
Dette er: Hvis arbeidet W er positivt, er ΔU negativt, og omvendt. På den annen side har vi også:
W = -nCVΔt (2)
Det etter å ha påført den ideelle gase -ligningen (PV = nRt), og erstatte og løse for t2 og T1 vi vil ha:
W = (cV/R) (P1V1 - P2V2) (3)
Å være verdien av r lik 0.082 L · atm/mol · K eller 8.314 J/mol · K
I adiabatiske prosesser er det viktig å kjenne C -forholdetP/CV kjent som γ:
γ = cP/CV (4)
Som gjør det mulig å etablere T-V- og P-V-forhold:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = S2V2γ (6)
Og også de omtrentlige varmen til CP og cV De varierer avhengig av om gassene er monoatomiske, diatomiske osv.
Oppgave 1
En gass utfører 600 j arbeid gjennom et isolert rom. Hva er endringen i dens indre energi? Reduserer eller øker temperaturen? Og med tanke på at det er en monoatomisk gass, beregner du også y.
Data:
W = +600j
ΔU = ¿?
γ =?
W arbeid er positivt fordi gass fungerer på omgivelsene. Å være inne i et isolert rom, q = 0, og derfor vil vi ha ligning (1):
ΔU = - w
Det vil si at ΔU er lik:
ΔU = - (+600j)
= -600j
Noe som betyr at den indre energien av gass reduserte 600 j. Hvis ΔU avtar, gjør også temperaturen, så gassen avkjøles som et resultat av å ha gjort arbeidet.
Fordi denne gassen er monoatomisk,
CV = 3/2 r
CP = 5/2 r
Og være
γ = cP/CV
= (5/2 r)/(3/2 r)
= 5/3 eller 1.66
Oppgave 2
I en container 7 mol O2 De ble komprimert fra et volum på 15 liter til 9 liter. Å vite at starttemperaturen var 300 K, beregne: arbeidet som er gjort på gass.
Data:
n = 7 mol eller2
T1 = 300 k
V1 = 15 l
V2 = 9 l
W = ¿?
Det er en irreversibel adiabatisk forståelse. Vi har to ligninger for å løse W:
W = -nCVΔt (2)
W = (cV/R) (P1V1 - P2V2) (3)
Presset kan beregne dem, men for å spare tid er det bedre å fortsette med den første av ligningene:
Kan tjene deg: destillert vannW = -nCVΔt
= -nCV (T2-T1)
Vi trenger cV og T2 Å bestemme w. Oksygen, som er en diatomisk gass, har en CV lik 5/2 r:
CV (ENTEN2) = 5/2 r
= 5/2 (8.314 J/mol · K)
= 20.785 J/mol · K
Vi må beregne t2. Vi henvender oss til ligning (5):
T1V1γ-1 = T2V2γ-1
Men før du bruker det, må du bestemme først CP og γ:
CP (ENTEN2) = 7/2 r
= 7/2 (8.314 J/mol · K)
= 29.099 J/mol · K
Å være γ lik:
γ = cP/CV
= (29.099 J / mol · K) / 20.785 J/mol · K
= 1.4
Så vi kan fjerne dette2 Fra ligning (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300k) (15L)1.4-1] / (9l)1.4-1
= 368.01 k
Og til slutt løser vi for W:
W = -nCVΔt
= -(7 mol o2)( tjue.785 J/mol · K) (368.01 K - 300 K)
= -9895.11 J O -9.895 KJ
Øvelse 3
En neonbeholder utvider adiabatisk og opprinnelig ved romtemperatur (t = 298K) fra 12 l til 14 l. Å vite at dets opprinnelige trykk var 3 atm, hva vil være arbeidet som er gjort av gassen?
Data:
T1 = 298 k
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
Ligning (3) lar oss bestemme W med verdiene på trykket:
W = (cV/R) (P1V1 - P2V2)
Men vi mangler CV Og s2.
Det endelige trykket kan beregnes med ligning (6):
P1V1γ = S2V2γ
Å være γ lik CP/CV. Siden neon er en monoatomisk gass, har vi dens C -verdierP og cV De er henholdsvis 5/2R og 3/2R. Vi beregner deretter γ:
γ = cP/CV
= (5/2R)/(3/2R)
= 5/3 eller 1.66
Vi fjerner s2 Fra ligning (6):
P2 = (S1V1γ) / V2γ
= [(3 atm) (12 l)5/3] / (14 l)5/3
= 1.40 atm
Og arbeidet vil være lik:
W = (cV/R) (P1V1 - P2V2)
= (3/2) [(3 atm) (12 l) - (1.40 atm) (14 l)] (101300 PA/1 atm) (0.001 m3/L) (KJ/1000 J)
= 2.49 KJ
Konverteringsfaktorer brukes til å konvertere l · atm a pa · m3, som tilsvarer 1 j. Neongass utvides, så trykket avtar, og når du jobber med omgivelsene, er dette positivt. Også den indre energien ΔU avtar, så vel som temperaturen, avkjøling i ekspansjonsprosessen.
Referanser
- Walter J. Moore. (1963). Fysisk kjemi. I kjemisk kinetikk. Fjerde utgave, Longmans.
- Iran. Levine. (2009). Prinsipper for fysikjemi. Sjette utgave. Mc Graw Hill.
- Wikipedia. (2020). Adiabatisk prosess. Hentet fra: i.Wikipedia.org
- Jones, Andrew Zimmerman. (18. august 2020). Themodynamikk: Adiabatisk prosess. Gjenopprettet fra: Thoughtco.com
- Devoe Howard & Neils Tom. (9. august 2020). Adiabatiske endringer. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Hva er den mekaniske ekvivalenten til varme?
- Maderismo historie, ideologi, representanter, konsekvenser »

