Fibrøse proteiner
- 2870
- 172
- Markus Fredriksen
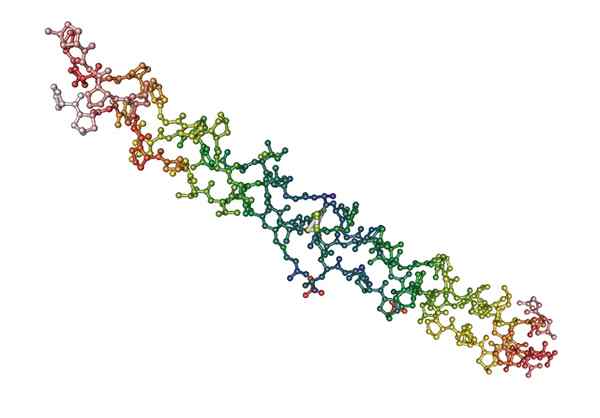
 Molekylær struktur av kollagen, et fibrøst protein av dyreopprinnelse (kilde: Nevit Dilmen [CC BY-S (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)] via Wikimedia Commons)
Molekylær struktur av kollagen, et fibrøst protein av dyreopprinnelse (kilde: Nevit Dilmen [CC BY-S (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)] via Wikimedia Commons) Hva er fibrøse proteiner?
De fibrøse proteiner, Også kjent som skleroproteiner, de er en klasse proteiner som er en viktig del av de strukturelle komponentene i enhver levende celle. Kollagen, elastin, keratin eller fibroine er eksempler på denne typen protein.
De oppfyller veldig forskjellige og komplekse funksjoner. Det viktigste er beskyttelsesbeskyttelses (for eksempel tornene til en piggsvin) eller støtte (for eksempel den som gir edderkopper stoffet som de vever og som holder dem suspendert).
Fibrøse proteiner er sammensatt av fullt utvidede polypeptidkjeder, som er organisert og danner en slags "fiber" eller "tau" med stor motstand. Disse proteinene er mekanisk veldig sterke og er uoppløselige i vann.
For det meste er komponentene i fibrøse proteiner fortløpende gjentatte aminosyrepolymerer.
Menneskeheten har prøvd.
Struktur
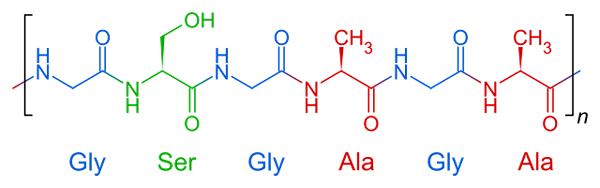 Repeterende struktur av silkefibroin, et fibrøst protein
Repeterende struktur av silkefibroin, et fibrøst protein Fibrøse proteiner har en relativt enkel sammensetning i strukturen. De er vanligvis dannet av tre eller fire forente aminosyrer mellom.
Det vil si at hvis et protein er sammensatt av aminosyrer som lysin, arginin og tryptofan, vil følgende aminosyre som vil bli med i tryptofan være en lysin igjen, etterfulgt av et arginin og et annet tryptofanmolekyl og så videre.
Det er fibrøse proteiner som har aminosyremotiver fordelt på to eller tre aminosyrer som er forskjellige fra de repeterende motivene i sekvensene deres, og i andre proteiner kan aminosyresekvensen være veldig varierende, av 10 eller 15 forskjellige aminosyrer.
Kan tjene deg: OvuliparosStrukturene til mange av fibrøse proteiner har blitt karakterisert med x -ray krystallografiteknikker og ved kjernemagnetiske resonansmetoder. Takket være dette har protein med fiberformet, rørformet, laminær, spiral, "trakt", etc. blitt detaljert, etc.
Hvert polypeptid med gjentatte motiver unike danner et glødetråd, og hvert glødetråd er en enhet av hundrevis av enheter som utgjør ultrastrukturen til et "fibrøst protein". Generelt er hvert glødetråd tilgjengelig på en spiralisk måte med hensyn til de andre.
Funksjoner
På grunn av fibernettet som danner fibrøse proteiner, består hovedfunksjonene deres av å tjene som strukturell støtte, motstand og beskyttelsesmateriale for vevene i de forskjellige levende organismer.
Beskyttelsesstrukturer sammensatt av fibrøse proteiner kan beskytte de vitale organene mot virveldyr mot mekaniske slag, ugunstige klimatiske forhold eller rovdyrangrep.
Spesialiseringsnivået av fibrøse proteiner er unikt i dyreriket. Edderkoppnett, for eksempel, er et essensielt støttestoff for livsstilen som edderkopper bærer. Dette materialet har unik motstand og fleksibilitet.

Så mye at for øyeblikket mange syntetiske materialer prøver å gjenskape fleksibiliteten og motstanden til edderkoppnett, selv ved å bruke transgene organismer for å syntetisere dette materialet gjennom bioteknologiske verktøy. Det skal imidlertid bemerkes at den forventede suksessen ennå ikke er oppnådd.
En viktig egenskap som fibrøse proteiner har er at de tillater sammenhengen mellom de forskjellige vevene til virveldyr.
Det kan tjene deg: Oksidorreduktaser: egenskaper, struktur, funksjoner, eksemplerI tillegg lar de allsidige egenskapene til disse proteinene levende organismer lage materialer som kombinerer motstand og fleksibilitet. Dette er i mange tilfeller det som danner de essensielle komponentene for bevegelse av musklene i virveldyr.
Fibrøse proteineksempler
Kollagen
Det er et protein av dyrs opprinnelse og er kanskje et av de mest tallrike i kroppen av virveldyr, siden de fleste bindevev komponerer. Kollagenet skiller seg ut for sine sterke, utvidbare, uoppløselige og kjemisk inerte egenskaper.
Komponerer - for det meste - til hud, hornhinne, mellomvirvelskiver, sener og blodkar. En kollagenfiber er sammensatt av en trippel parallell propell som er nesten i sin tredje del bare aminosyreglycinet.
Dette proteinet danner strukturer kjent som "kollagenmikrofibriller", som består av forening av flere trippelkollagenpropeller med hverandre.
Elastin
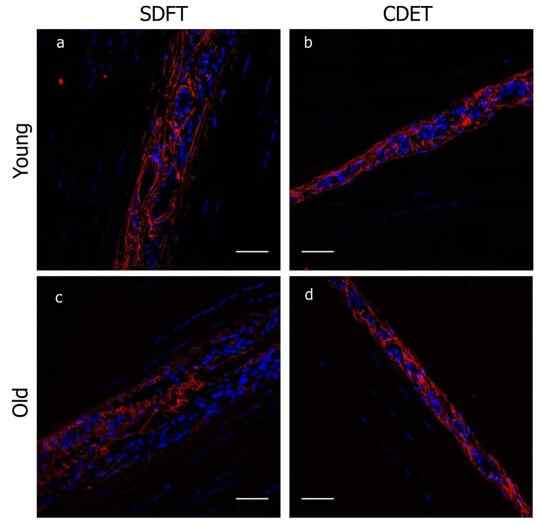 Elastin av hestene til en hest. Kilde: Marta S. C. Godinho, Chavaunne t. Thorpe, Steve E. Greenwald, & Hazel R. C. Skjerm, CC By-SA 4.0, via Wikimedia Commons
Elastin av hestene til en hest. Kilde: Marta S. C. Godinho, Chavaunne t. Thorpe, Steve E. Greenwald, & Hazel R. C. Skjerm, CC By-SA 4.0, via Wikimedia Commons I likhet med kollagen er elastin et protein som er en del av bindevevet. I motsetning til den første gir det imidlertid elastisitet til vev, i stedet for motstand.
Elastinfibre er sammensatt av aminosyrer for valin, prolin og glycin. Disse aminosyrene er svært hydrofobe egenskaper, og det er bestemt at elastisiteten til dette fibrøse proteinet skyldes elektrostatiske interaksjoner i dets struktur.
Elastin er rikelig i vev som er intensivt utsatt for forlengelses- og avslapningssykluser. I virveldyr finnes det i arterier, leddbånd, lunger og hud.
Keratin
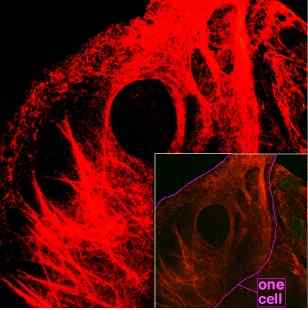 Keratin. Kilde: Maksim, CC BY-SA 3.0, via Wikimedia Commons
Keratin. Kilde: Maksim, CC BY-SA 3.0, via Wikimedia Commons Keratin er et protein som hovedsakelig er i det ektodermale laget av virveldyr. Dette proteinet danner viktige strukturer som hår, negler, torner, fjær, horn, blant andre.
Det kan tjene deg: flora og fauna i den tropiske skogenKeratin kan være sammensatt av a-queratin eller ß-karkatin. Α-queratin er mye mer stiv enn ß-cheatin. Dette er fordi keratin-a består av α-propeller, som er rike på cystein aminosyren, som har evnen til å danne disulfidbroer med andre like aminosyrer.
I ß-som derimot er det sammensatt i en større andel polare og apolare aminosyrer, som kan danne hydrogenbroer og organisere i brett β-ark. Dette betyr at strukturen er mindre motstandsdyktig.
Fibroin
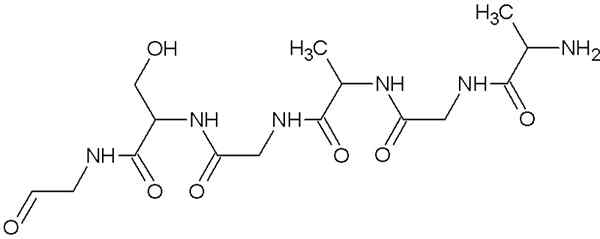 Molekylær struktur av fibroin
Molekylær struktur av fibroin Dette er proteinet som komponerer edderkoppnett og tråder produsert av silkeormer. Disse trådene er for det meste sammensatt av glycin, serin og alaninaminosyrer.
Strukturen til disse proteinene er β -ark organisert antiparallela til orienteringen av glødetråden. Denne egenskapen gir den motstand, fleksibilitet og liten distriktskapasitet.
Fibroinet er ikke veldig løselig i vann og skylder sin store fleksibilitet til den store stivheten som foreningen av aminosyrer i sin primære struktur og Vander Waals -broene, som dannes mellom de sekundære gruppene i aminosyrene.

