Ekvivalenspunkt

- 3256
- 192
- Dr. Andreas Hopland
 Ekvivalenspunktet er konsentrasjonen av støkiometrisk merverdi lik mengden analyt
Ekvivalenspunktet er konsentrasjonen av støkiometrisk merverdi lik mengden analyt Hva er ekvivalenspunktet?
Han ekvivalenspunkt Det er en der to kjemiske stoffer er blitt reagert fullstendig. I syre-base-reaksjoner indikerer dette punktet når en hel syre eller en base er blitt nøytralisert.
Dette konseptet er hver dag i volumetriske grader eller verdivurderinger, og bestemmes av enkle matematiske beregninger.
I denne forbindelse er en grad prosessen der et volum av en kjent konsentrasjonsløsning blir nøye tilsatt, kalt en titulær, til en ukjent konsentrasjonsløsning, for å oppnå sin konsentrasjon.
Bruken av en pH -indikator gjør det mulig å vite øyeblikket i hvilken graden slutter. Indikatoren legges til løsningen som blir tittelen for å gjøre kvantifiseringen av konsentrasjonen du vil vite.
En syre-baseindikator er en kjemisk forbindelse hvis farge avhenger av hydrogenkonsentrasjonen eller pH i mediet.
Fargeendringen på indikatoren indikerer sluttpunktet i graden, selv om det ikke er ekvivalenspunktet. Ideelt sett må begge punktene sammenfalle, men i virkeligheten kan fargenendringen oppstå noen dråper etter syrenneutralisering eller base er fullført.
Hva er ekvivalenspunktet?
En løsning av en ukjent konsentrasjonssyre plassert i en kolbe.
Valg av en indikator må gjøres på en slik måte at den endrer farge på det punktet at den samme mengden kjemiske ekvivalenter av titreringsløsningen og den ukjente konsentrasjonsløsningen har reagert.
Dette er ekvivalenspunktet, mens punktet der en indikator endrer farge kalles sluttpunktet, der tittelen slutter.
Kan tjene deg: Hypotonisk løsning: Komponenter, forberedelser, eksemplerEndelig poeng
Ioniseringen eller dissosiasjonen av indikatoren er representert som følger:
Hin +H₂o i- + H3ENTEN+
Og har derfor en konstant Ka
Ka = [h3ENTEN+] [In-] / [Hin]
Forholdet mellom den ikke -dissosierte indikatoren (HIN) og den dissosierte indikatoren (i-) Bestem fargen på indikatoren.
Tilsetningen av en syre øker Hin -konsentrasjonen og produserer fargen 1 av indikatoren. I mellomtiden favoriserer tilsetningen av en base en økning i konsentrasjonen av den dissosierte indikatoren (i-) (Farge 2).
Det er ønskelig at ekvivalenspunktet sammenfaller med sluttpunktet. For å gjøre dette er en indikator valgt med et fargeendringsintervall som inkluderer ekvivalenspunktet. I tillegg handler det om å redusere enhver feil som gir en forskjell mellom ekvivalenspunktet og sluttpunktet.
Standardisering eller vurdering av en løsning er en prosess der den eksakte konsentrasjonen av en løsning bestemmes. Det er metodisk en grad, men strategien som fulgte er annerledes.
En løsning av den primære standarden er plassert i kolben, og den titulære løsningen som blir standardisert blir lagt til med en burette.
Ekvivalens av titrering av en sterk syre med en sterk base
100 ml 0,1 M HCl plasseres i kolben og tilsettes gradvis, ved hjelp av en burette, en 0,1 m NaOH -løsning, og bestemmer pH -endringene i løsningen som forårsaker saltsyre.
Til å begynne med, før du tilsetter NaOH, er pH i HCl -løsningen 1.
Den sterke basen (NaOH) tilsettes og pH øker gradvis, men den forblir en sur pH, siden overflødig syre bestemmer denne pH.
Kan tjene deg: kaliumjodid (ki): struktur, egenskaper, innhenting, bruk, risikoHvis NaOH fortsetter, er det en tid hvor ekvivalenspunktet er nådd, der pH er nøytral (pH = 7). Syren har reagert med basen som konsumerer, men det er ikke noe overskudd av base ennå.
Konsentrasjonen av natriumklorid dominerer, som er et nøytralt salt (heller ikke NA+ heller ikke cl- er hydrolysert).
Hvis NaOH fortsetter, fortsetter pH -pH å øke, og blir mer grunnleggende enn ekvivalenspunktet, fordi NaOH -konsentrasjonen dominerer.
Ideelt sett bør fargeendringen av indikatoren oppstå til en pH = 7, men på grunn av den brå formen på titlingskurven, kan fenolftalein brukes som endres til en blekrosa farge til en pH rundt 8.
Fallbasert svak-basert gradskurve
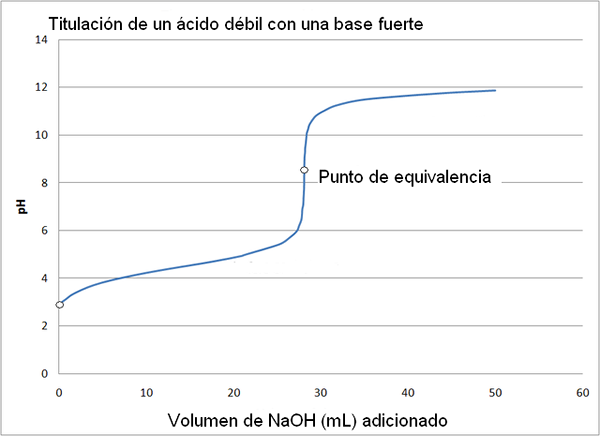 Svak syre og sterk basetitreringskurve. Kilde: Wikimedia Commons
Svak syre og sterk basetitreringskurve. Kilde: Wikimedia Commons Titreringskurven til en sterk syre med en sterk base er lik den for det øvre bildet. Den eneste forskjellen mellom begge kurvene er at den første har en mye mer brå pH -endring, mens det i titreringskurven til en svak syre med en sterk base kan sees at endringen er mer gradvis.
I dette tilfellet har en svak syre tittelen, for eksempel eddiksyre (CH3COOH) med en sterk base, natriumhydroksyd (NaOH). Reaksjonen som oppstår i graden kan skjematisere som følger:
NaOH +Ch3COOH => CH3COO-Na+ + H₂o
I dette tilfellet dannes acetatbufferløsningen med en PKA = 4,74. Det polstrede området kan sees i den lette og nesten umerkelige endringen før pH 6.
Det kan tjene deg: en aminogruppe (NH2): Struktur, egenskaper, eksemplerEkvivalenspunktet, som indikert av bildet, er rundt 8.72 og ikke 7. Dette er fordi Cho3COO- Det er en anion som etter hydrolyzar genererer oh-, som baserer Ph:
Ch3COO- + H₂o Ch3COOH +OH-
Stadier
Eddiksyre -titrering med natriumhydroksyd kan deles inn i 4 trinn for analyse.
- Før du begynner å tilsette basen (NaOH), er pH i løsningen sur og avhenger av dissosiasjon av eddiksyre.
- Når natriumhydroksyd tilsettes, dannes acetatdempingsløsningen, men på samme måte økes dannelsen av den konjugerte acetatbasen, noe som fører til en økning i løsningen av løsningen av løsningen.
- PH i ekvivalenspunktet oppstår en pH på 8,72, som ærlig er alkalisk.
Ekvivalenspunktet har ikke en konstant verdi og varierer avhengig av forbindelsene som er involvert i graden.
- Ved å fortsette å tilsette NaOH, etter å ha nådd ekvivalenspunktet, øker pH på grunn av overflødig natriumhydroksyd.
Indikatorvalg i henhold til ekvivalenspunktet
Fenolftalein er nyttig for å bestemme ekvivalenspunktet i denne graden, fordi det har sitt fargevirkningspunkt i en pH rundt 8, som faller inn i pH -området for titrering av eddiksyre som inkluderer punktekvivalensen (pH = 8,72).
På den annen side er metylrød ikke nyttig for å bestemme ekvivalenspunktet, siden det endrer farge i pH -intervallet 4,5 til 6,4.
Referanser
- Helmestine, Anne Marie. Ekvivalenspunktdefinisjon. Gjenopprettet fra Thoughtco.com
- Forskjell mellom endepunkt og ekvivalenspunkt. Hentet fra forskjell mellom.nett
- Ekvivalenspunkt: Definisjon og beregning. Studie ble frisk.com

