Trippelpunkt
- 2943
- 549
- Mathias Aas
Hva er trippelpunktet?
Han Trippelpunkt Det er et begrep innen termodynamikk som refererer til temperaturen og trykket som det samtidig er tre faser av et stoff i en termodynamisk likevektstilstand. Dette punktet eksisterer for alle stoffer, selv om forholdene der de oppnås i varierer veldig mellom hver.
Et trippelpunkt kan også innebære mer enn en fase av samme type for et spesifikt stoff; det vil si at to forskjellige faste, væske- eller gassfaser observeres. Helium, spesielt dens helio-4-isotop, er et godt eksempel på et trippelpunkt som involverer to individuelle væskefaser: normal og overflødig væske.
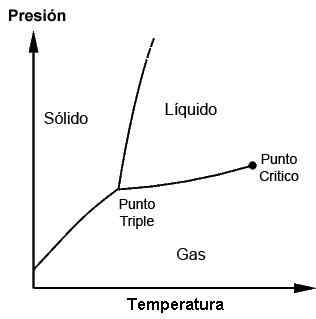
 Fasediagram som viser trippelpunktet og det kritiske punktet
Fasediagram som viser trippelpunktet og det kritiske punktet Hva er det for og når trippelpunktet brukes?
Trippelpunktet for vann brukes til å definere Kelvin, den termodynamiske temperaturbasenheten i International Units System (SI). Denne verdien er satt per definisjon i stedet for å måle.
Trippelpunktene til hvert stoff kan observeres ved bruk av fasediagrammer, som er plottede grafer som tillater å demonstrere de begrensende forholdene til de faste, flytende, gassformige fasene (og andre, i spesielle tilfeller) av et stoff mens de utøver endringer i temperatur, trykk og/eller løselighet.
Et stoff kan finnes i smeltepunktet der faststoffet møter væsken; Det kan også finnes på kokepunktet der væsken møter gassen. Imidlertid er det på trippelpunktet hvor de tre fasene oppnås. Disse diagrammer vil være forskjellige for hvert stoff, som det vil bli sett senere.
Kan tjene deg: API Gravity: Skala og klassifisering av råoljeTrippelpunktet kan brukes effektivt i kalibreringen av termometre ved bruk av trippelpunktceller.
Dette er prøver av stoffer under isolerte forhold (innenfor "celler" av glass) som er på deres trippelpunkt med kjente temperatur- og trykkforhold, og dermed letter studiet av presisjonen til termometermålingene.
Studien av dette konseptet i utforskningen av planeten Mars har også blitt brukt, der havnivået ble forsøkt under oppdrag som ble utført på 1970 -tallet.
Trippel vann
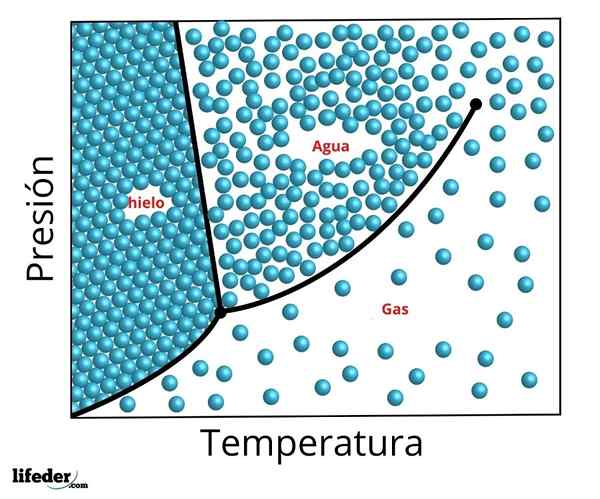 Fasediagram over trippelpunktet for vann. Trippelpunktet er det nedre punktet og kritikeren det øvre punktet
Fasediagram over trippelpunktet for vann. Trippelpunktet er det nedre punktet og kritikeren det øvre punktet De nøyaktige forholdene for trykk og temperatur der vann sameksisterer i sine tre faser i likevekt - flytende vann, is og damp - forekommer ved en temperatur på nøyaktig 273,16 K (0,01 ºC) og et delvis trykk av damp 611,656 Pascals (0,00603659 atm ).
På dette tidspunktet er det mulig å konvertere stoffet til noen av de tre fasene med minimale endringer i temperaturen eller trykket. Selv når det totale systemtrykket kan være lokalisert over det som kreves for trippelpunktet, hvis det delvise damptrykket er på 611.656 PA, vil systemet nå trippelpunktet på samme måte.
Det er mulig å observere i forrige figur representasjonen av trippelpunktet (eller Trippelpunkt, på engelsk) av et stoff hvis diagram er lik vannet, i henhold til temperaturen og trykket som kreves for å nå denne verdien.
Når det gjelder vann, tilsvarer dette punktet det minste trykket som flytende vann kan eksistere. For å presse mindre til dette trippelpunktet (for eksempel i et vakuum), og når en konstant trykkoppvarming brukes, vil fast is konvertere direkte til vanndamp uten å gå gjennom væske; Dette er en prosess som kalles sublimering.
Det kan tjene deg: Teori om Big Bang: Kjennetegn, stadier, bevis, problemerUtover dette minimumstrykket (PTp), vil isen først smelte for å danne flytende vann, og bare der vil den fordampe eller koke for å danne damp.
For mange stoffer er temperaturverdien ved dets trippelpunkt den minste temperaturen som væskefasen kan eksistere, men dette skjer ikke i tilfelle vann. For vann skjer dette ikke, siden issmeltepunktet avtar basert på trykket, som vist med den grønne stiplede linjen i forrige figur.
I høytrykksfaser har vann et ganske komplekst fasediagram, som viser femten kjente isfaser (ved forskjellige temperaturer og trykk), i tillegg til ti forskjellige trippelpunkter som vises i følgende figur:
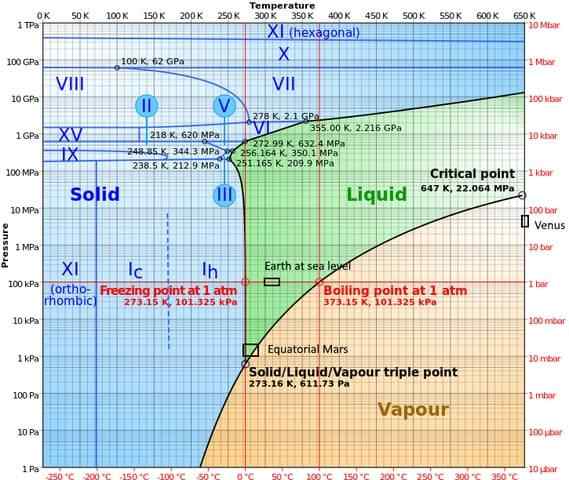
Det kan bemerkes at i høye trykkforhold kan is eksistere i balanse med væsken; Diagrammet viser at fusjonspunktene øker med trykket. Ved lave konstante temperaturer og økende trykk kan damp transformeres direkte til is, uten å gå gjennom væskefasen.
De forskjellige forholdene som oppstår på planetene der trippelpunktet (land til sjøs og i ekvatorialområdet i Mars) er også representert i dette diagrammet).
Diagrammet gjør det klart at trippelpunktet varierer avhengig av stedet av trykk og atmosfærisk temperatur, og ikke bare ved eksperimentørintervensjon.
Trippelpunkt for cykloheksan
Cyclohexan er en cyclocano som har molekylformelen til C6H12. Dette stoffet har særegenheten ved å ha trippelpunktforhold som enkelt kan reproduseres, som for vann, siden dette punktet er plassert ved en temperatur på 279,47 K og et trykk på 5.388 kPa.
Det kan tjene deg: Live anklager: konsept, egenskaper, eksemplerUnder disse forholdene er hirarforbindelsen, størkning og smelting med minimale endringer i temperatur og trykk blitt observert.
Triple Benzen Point
I et tilfelle som ligner på cykloheksan, benzen (organisk forbindelse med kjemisk formel C6H6) har lett reproduserbare trippelpunktforhold i et laboratorium.
Verdiene er 278,5 K og 4,83 kPa, så eksperimentering med dette nybegynnernivået er også vanlig.
Referanser
- Wikipedia. (s.F.). Wikipedia. Hentet fra IN.Wikipedia.org
- Britannica, e. (1998). Britannica Encyclopedia. Hentet fra Britannica.com
- Power, n. (s.F.). Kraft kjernefysisk. Hentet fra atomkraft.nett
- Wagner, w., Saul, a., & PRUB, til. (1992). Internasjonale ligninger for trykket langs smelting og langs sublimeringskurven for vanlig vann. Bochum.
- Penoncello, s. G., Jacobsen, r. T., & Goodwin, a. R. (nitten nitti fem). Til termodynamisk eiendomsformulering for cyclohexane.

