Aluminiumsulfid (AL2S3) struktur, egenskaper, bruk
- 4027
- 381
- Jonathan Moe
Han Aluminiumsulfid (Til2S3) Det er en lysegrå kjemisk forbindelse dannet ved oksidasjon av metallisk aluminium når man mister elektronene til det siste energinivået og blir en kation, og ved reduksjon av ikke -metallisk svovel, ved å få elektroner overført av aluminium og bli en anion.
For at dette skal skje og aluminium kan gi elektronene, er det nødvendig at du presenterer tre hybrid orbitaler SP3, som gir muligheten for å danne lenker til elektroner fra svovel.
Vannaluminiumsulfidfølsomhet innebærer at den i nærvær av vanndamp som finnes i luften, kan reagere produserende aluminiumhydroksyd (Al (OH)3), hydrogensulfid (h2S) og hydrogen (h2) gassformig; Hvis sistnevnte akkumuleres kan forårsake en eksplosjon. Derfor bør aluminiumsulfidemballasje gjøres ved hjelp av hermetikkbeholdere.
På den annen side, siden aluminiumsulfid har reaktivitet med vann, gjør dette det til et element som ikke har noe løsningsmiddeloppløsningsmiddel.
Kjemisk struktur
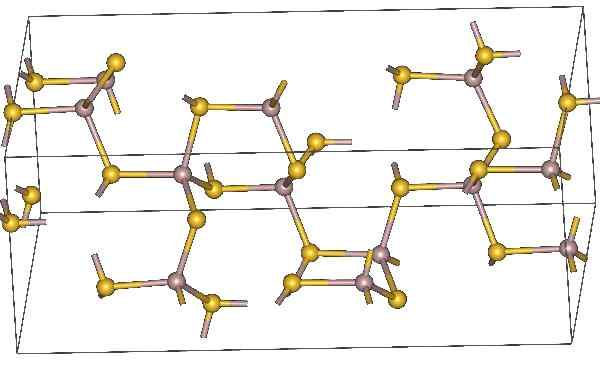
 Kjemisk struktur av aluminiumsulfid. Gule atomer representerer svovel. Kilde: Materialscientist, CC BY-SA 3.0, via Wikimedia Commons
Kjemisk struktur av aluminiumsulfid. Gule atomer representerer svovel. Kilde: Materialscientist, CC BY-SA 3.0, via Wikimedia Commons Molekylær formel
Til2S3
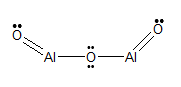
Strukturformel
 Nomenklatur
Nomenklatur
- Aluminiumsulfid.
- DI aluminium trisulfid.
- Aluminiumsulfid (III).
- Aluminiumsulfid.
Aluminiumsulfidegenskaper
 Aluminiumsulfidutseende
Aluminiumsulfidutseende Kjemiske forbindelser viser for det meste to typer egenskaper: fysisk og kjemisk.
Fysiske egenskaper
Molmasse
150,158 g/mol
Tetthet
2,02 g/ml
Smeltepunkt
1100 ° C
Vannløselighet
Uoppløselig
Kjemiske egenskaper
En av hovedreaksjonene i aluminiumsulfid er med vann, for eksempel underlag eller hovedreaktiv:

I denne reaksjonen kan dannelsen av aluminiumhydroksyd og hydrogensulfid observeres hvis det er i form av gass, eller sulfidsyre hvis den blir oppløst i vannet i form av en løsning. Hans tilstedeværelse blir identifisert av lukten av råtne egg.
Kan tjene deg: kjemiske løsningerBruk og applikasjoner
I Super Cardpisors
Aluminiumsulfid brukes til fremstilling av nano -nettkonstruksjoner som forbedrer det spesifikke overflatearealet og elektrisk ledningsevne, slik at en høy kapasitans og energitetthet kan oppnås hvis anvendbarhet er supercaugades.
Grafenoksid (GO) - Graphene er en av de alotropiske former for karbon - har tjent som en aluminiumsulfidstøtte (Al2S3) Med en hierarkisk morfologi som ligner på nanorambután produsert ved bruk av den hydrotermiske metoden.
Grafenoksidhandling
Egenskapene til grafenoksid som støtte, så vel som høy elektrisk ledningsevne og overflateareal, gjør nanorambutan2S3 være elektrokjemisk aktiv.
De spesifikke CV -kapasitanskurvene med godt definerte redoks -topper bekrefter den pseudokapacitive oppførselen til nanorambutan2S3 Hierarkisk, vedvarende i grafenoksid i NaOH 1M elektrolytt. De spesifikke CV -kapasitansverdiene oppnådd fra kurvene er: 168,97 ved 5MV/S letehastighet.
I tillegg er det observert en god galvanostatisk utladningstid på 903 µs, en flott spesifikk kapasitans på 2178,16 til strømmen på 3 mA/cm strøm2. Energitettheten beregnet fra galvanostatisk utslipp er 108,91 WH/kg, til strømtettheten på 3 mA/cm2.
Elektrokjemisk impedans bekrefter således den pseudokapacitive naturen til den hierarkiske nanorambutanelektroden til2S3. Elektrodestabilitetstesten viser en oppbevaring av 57,84 % av den spesifikke kapasitansen på opptil 1000 sykluser.
Eksperimentelle resultater antyder at nanorambutan2S3 Hierarkisk er egnet for supercaiding applikasjoner.
Kan tjene deg: kromhydroksid: struktur, egenskaper, syntese, brukI sekundære litiumbatterier
Med den hensikt å utvikle et sekundært litiumbatteri med høy energitetthet, ble aluminiumsulfid studert (Al2S3) som aktivt materiale.
Det første tiltaket for nedlastingskapasitet2S3 Det var omtrent 1170 mAh g-1 til 100 m g-1. Dette tilsvarer 62 % av den teoretiske kapasiteten for sulfid.
Al2S3 Han viste dårlig kapasitetsretensjon i det potensielle området mellom 0,01 V og 2,0 V, hovedsakelig på grunn av den strukturelle irreversibiliteten til belastningsprosessen eller utvinning av Li.
XRD- og K-XES-analyse for aluminium og svovel indikerte at overflaten til Al2S3 reagerer reversibelt under lasting og lossingsprosesser, mens kjernen i Al2S3 Han viste strukturell irreversibilitet, fordi Lial og Li2S ble dannet fra Al2S3 I den første nedlastingen, og da ble de igjen som de var.
Risiko
- I kontakt med vann frigjør brennbare gasser som kan brenne spontant.
- Forårsake hudirritasjon.
- Forårsake alvorlig okulær irritasjon.
- Kan forårsake luftveisirritasjon.
Informasjon kan variere mellom varsler avhengig av urenheter, tilsetningsstoffer og andre faktorer.
Førstehjelpsprosedyre
Generell behandling
Se etter legehjelp hvis symptomene vedvarer.
Spesialbehandling
Ingen
Viktige symptomer
Ingen
Innånding
Ta offeret utenfor. Levere oksygen hvis pusting er vanskelig.
Inntak
Administrer ett eller to glass vann og induserer oppkast. Aldri fremkalle oppkast eller gi noe i munnen til en bevisstløs person.
Pels
Vask det berørte området med myk såpe og vann. Slett forurensede klær.
Øyne
Vask øynene med vann, blink ofte i flere minutter. Fjern kontaktlinser i tilfelle du har dem og fortsett å skylle.
Det kan tjene deg: Cruise for Crucible: Egenskaper, funksjoner, bruk eksemplerBrannslukkingstiltak
Betennbarhet
Ikke brannfarlig.
Utryddelsesmidler
Reagere med vann. Ikke bruk vann: Bruk CO₂, sand og støvslukningsapparat.
Kampprosedyre
Bruk et autonomt pusteapparat med fullstendig beskyttelse. Bruk klær for å unngå kontakt med hud og øyne.
Referanser
- Helse og risiko.com, (s.f), Definisjon, konsepter og artikler om helse, risiko og miljø. Hentet: helse og risiko.com
- Aluminiumsulfid. (s.). I Wikiwand. Hentet 9. mars 2018: Wikiwand.com
- Webelementer.(s.).Dialuminium Trisulpfide, gjenopprettet 10. mars 2018: Webelements.com
- LTS Research Laboratories, Inc (2016), Safety Data Sheet Aluminium Sulfide: Ltschem.com

