Strukturradio, egenskaper, bruk, oppnå
- 2715
- 559
- Marius Aasen
Han radio Det er et metallisk element som tilhører gruppe 2 i det periodiske tabellen, de alkalinotiske metaller, hvis kjemiske symbol er RA. Det er det siste medlemmet av denne gruppen, som ligger under barium, og foregående radioaktive elementer som thorium og uran; Radius er imidlertid omtrent en million ganger mer radioaktiv og derfor farligere enn uran i seg selv.
Det er et element omgitt av utrolige og uheldige historier, alt som et resultat av uvitenheten om dets negative effekter på helsen. Den blålige lysheten i saltene og vandige oppløsninger betatt forskerne Pierre og Marie Curie, som oppdaget det i året 1898 og analyserte en uforklarlig og sterk stråling fra prøver av Pechblenda -malmen, som uran- og uraninnholdet hadde fjernet uraninnholdet og polonium.
 Illustrasjon av Marie Curie, Discoverer of the Radio
Illustrasjon av Marie Curie, Discoverer of the Radio Eliminert uran og polonium, Curie og konkluderte med at det var et annet element til stede i Pechblenda, ansvarlig for den sterke strålingen, som genialt kunne kvantifisere. Dette nye elementet var kjemisk veldig likt barium; I motsetning til dens spektrale grønne linjer, var de av dette imidlertid av en karminfarge.
Etter behandling, rensing og analyse av tonnevis av pechblenda, oppnådde de 0.1 mg racl2. Da hadde de i 1902 allerede bestemt atommassen til radioen, hvis navn avledet fra det latinske ordet 'Radius', som betyr 'Ray'. Radioen er bokstavelig talt et strålende element.
Åtte senere, i 1910, klarte Marie Curie sammen med den franske kjemikeren André Louis Debierne, å isolere radius i metallformen sin ved RACL -elektrolyse2 Bruker kvikksølv. Forskningsfeberen ble født, som senere ble en alarmerende kommersiell, kulturell og medisinsk sensasjon.
[TOC]
Struktur
Radioen er et metall hvis atomer er veldig klumpete. En konsekvens av dette er at krystallene deres er få tette (selv om de er litt mer enn bario), og adoptere en kubikkstruktur sentrert på kroppen (BCC). Ut av denne strukturen rapporteres ingen andre alotrope til andre temperaturer eller trykk.
Elektronisk konfigurasjon

Den elektroniske konfigurasjonen for radioen er som følger:
[RN] 7s2
Det oksiderer med enorm letthet å bli kation RA2+, som er isolektronisk for edel radongass. Derfor inneholder alle radiusforbindelser kationen RA2+, etablere overveiende ioniske interaksjoner; Imidlertid anslås det at det er mulig at det på grunn av relativistiske effekter kan danne koblinger med bemerkelsesverdig kovalent karakter (RA-X).
Kan tjene deg: kaliumbenzoate: struktur, egenskaper, innhenting, brukRadioegenskaper
 Radioforbindelsesprøve
Radioforbindelsesprøve Fysisk utseende
Radioen er et sølvhvit metall, som umiddelbart farger gul og mørkner når den reagerer med nitrogenet fra luften for å danne sin nitruro, RA3N2. For å være så vanskelig å manipulere, er det få fysiske egenskaper ved radius som er bestemt direkte.
Atomnummer
88
Molmasse
226.03 g/mol
Smeltepunkt
Rundt 700 ºC. Denne størrelsesorden har ikke vært i stand til å bestemmes nøyaktig.
Kokepunkt
Radioen koker mellom 1100 og 1700 ºC. Denne store unøyaktighetsmarginen gjenspeiler igjen komplikasjonene ved å manipulere et så ustabilt metall.
Tetthet
5.5 g/cm3
Fusjonsvarme
8.5 kJ/mol
Fordampningsvarme
113 kJ/mol
Oksidasjonstilstand
Radioen har en enkelt +2 oksidasjonstilstand.
Elektronegativitet
0.9. Denne verdien tilsvarer trofast den sterke elektropositive karakteren av radius.
Ioniseringsenergier
Først: 509.3 kJ/mol
For det andre: 979 kJ/mol
Radioaktivitet
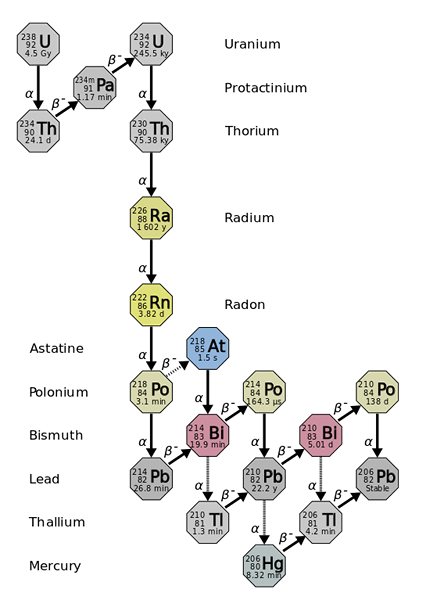 Radius stammer fra de radioaktive fallene med tyngre og mer ustabile elementer, som med uran-238-isotopen. Kilde: Bruker: Tosaka, CC av 3.0, via Wikimedia Commons
Radius stammer fra de radioaktive fallene med tyngre og mer ustabile elementer, som med uran-238-isotopen. Kilde: Bruker: Tosaka, CC av 3.0, via Wikimedia Commons Radius er omtrent en million ganger mer radioaktiv enn uran. Dette skyldes hovedsakelig at andre isotoper er produsert av den, for eksempel 222RN (overlegen bilde), som igjen forfaller ved å avgi α -partikler for å transformere til isotopen 218Po. En radioprøve utsteder derfor store mengder av α- og β -partikler-, så vel som γ -stråler.
For eksempel et gram radio, lider 3.7 · 1010 Oppløsning per sekund, mål som tjente til å definere CI -enheten, kalt Curie. Denne energien er nok til å varme opp en prøve på 25 gram vann 1 ° C per time.
Hvis forfallkjeden blir observert, vil det sees at den første isotopen, 238U, du har en t1/2 av 4.5 giga år (milliarder av år); Mens i stedet er det 226Ra har en t1/2 1600 år, som også produserer isotoper med t1/2 av bare dager, minutter og sekunder.
Radioens radioaktivitet og forbindelser er ioniserende, så lysstoffrør, til og med de omkringliggende atomer, lyser opp om natten, og blir i stand til å utløse eksplosive reaksjoner. Denne egenskapen er kjent som radioluminescens.
Forbindelser og reaktivitet
Når salter eller radioforbindelser blir oppvarmet i en lighter, skyter de en karminflamme. Slike faste stoffer er vanligvis hvite eller fargeløse, men de er farget gule og til slutt mørkere som et resultat av radioaktiviteten til radioatomer. Hvis de har bariumforurensninger, kan de vise rosa toner.
Kan tjene deg: Dobbelt substitusjonsreaksjonRadiokjemien er veldig lik den fra Bario, som om de var to uatskillelige brødre, Ra-BA. Begge danner de samme saltene, uoppløselige i vann, med forskjellen på at radius er litt mer uoppløselige. For eksempel radiosulfat, sateng4, Det er mer uoppløselig enn bariumsulfat, baso4; Det er faktisk den mest uoppløselige sulfat som noensinne er kjent: 2.1 mg av det oppløses bare i 1 liter vann.
På den annen side, radiohydroksid, RA (OH)2, Det er det mest oppløselige og grunnleggende av alle hydroksider av sine jevnaldrende.
I løsning, RA -kationer2+, I stedet for å oppføre seg som Lewis -syrer, er de grunnleggende, siden deres store størrelse gjør det umulig for molekylene.
Den kjemiske analogien mellom radioen og bariet går tilbake til dette metallet som er vanskelig å skille, fordi saltene kopierer med barium.
Radiobruk/applikasjoner
Lysende klokker
 De lysende og fosforescerende klokkene var veldig ønsket på det nittende århundre, for deres visuelle attraktivitet og for å inneholde den anerkjente radioen i maleriene sine. Kilde: Weapon95, CC BY-SA 3.0, via Wikimedia Commons
De lysende og fosforescerende klokkene var veldig ønsket på det nittende århundre, for deres visuelle attraktivitet og for å inneholde den anerkjente radioen i maleriene sine. Kilde: Weapon95, CC BY-SA 3.0, via Wikimedia Commons Den mest populære og kontroversielle bruken av radius skulle brukes som tilsetningsstoff for maleriene på klokkene. Atomene ble innlemmet i pastyformuleringene av sinksulfid, Zns, som absorberte radioaktive utslipp for å frigjøre et grønt og fosforescerende lys. Malingen ble påført klokkehåndene (overlegen bilde).
Problemet med denne bruken var i den kontinuerlige radioaktive eksponeringen som påvirket brukerne av disse klokkene; Eller verre, for arbeiderne som malte dem i fabrikkene.
I 1924 begynte flere ansatte som jobbet i en malingsindustri, senere kjent som Radio Girls (Radium Girls), å lide av beinkreft, deformasjoner av kjever og tenner, fordi de måtte slikke spissen fra børstene dine for å være i stand til å bruke radioaktiv maling på klokker.
Dette, pluss uvitenhet om radius, og den lille etikken om ikke å innføre beskyttelsesmål som garanterte arbeidstakernes sikkerhet, endte i en juridisk skandale som revolusjonerte yrkesmessige sikkerhetslover.
Kan tjene deg: leie halogenuros: egenskaper, innhenting, eksemplerRadiomalerier sluttet å bli produsert i 1960; Selv om det i dag er flere samleobjekter som har det på overflatene sine.
Radithor
 Radithor -flaske utstilt på National Museum of Nuclear Science and History, New Mexico. Kilde: Sam Larussa fra United States of America, CC BY-SA 2.0, via Wikimedia Commons
Radithor -flaske utstilt på National Museum of Nuclear Science and History, New Mexico. Kilde: Sam Larussa fra United States of America, CC BY-SA 2.0, via Wikimedia Commons Radithor var et av mange farmasøytiske og kosmetiske produkter som forkynte radioens effektivitet for å bekjempe tusen og en syke. Den inneholdt en mikrometrisk radiomengde, som den skulle kurere alle fordøyelses- og endokrine sykdommer. Imidlertid, i 1932, etter Eden Byers død, en av dens mest inderlige forbrukere, forlot Radithor markedet.
Strålebehandling
Ikke alle radiobruk var sensasjonelle, pseudovitenskapelige og skruppelløse (eller kriminelle). Det var også virkelig gunstig for helsen, i det minste til en tid. Radiosalter, racl2 og Rab2, De brukes i kreftbehandling, spesielt beinkreft.
Isotopen 223RA, når den er forvirret av kalsiumioner i metabolisme, ender opp med å ødelegge kreftceller som ligger i beinet.
Imidlertid har mange av de terapeutiske bruken av radius blitt erstattet av tryggere, økonomiske og effektive isotoper, for eksempel 60Co og 137CS.
Å skaffe
Radioen er et av elementene hvis produksjon er knapp: omtrent 100 gram i året over hele verden. Tonn uranoransje, så som pechblenda (eller uraninitt) malm behandles etter Curie -metoden, som består i behandling4-Baso4.
Satengblandingen4-Baso4 Det ble forvandlet til deres respektive klorider, RACL2-Bacl2, skille kationene RA2+ ved fraksjonelle krystalliseringer og til slutt rensende ioniske kromatografiteknikker. Racl2 Det reduseres ved elektrolyse, eller reduserer den med metallaluminium til 1200 ºC.
Isotoper
Alle radioisotoper er radioaktive. Fire av dem eksisterer i naturen som produkter av det radioaktive forfallet av atomer av 232Th, 235U og 238ELLER.
Disse fire isotopene er: 223Ra (t1/2= 11.4 dager), 224Ra (t1/2= 3.64 dager), 226Ra (t1/2= 1600 år) og 228RA (5.75 år). Det er klart at nesten alle radiomomer består av isotopblandinger 226Ra og 228RA, fordi andre går raskt i oppløsning.
Han 226RA er den mest stabile av alle isotoper av radioen, alle andre er for ustabile, med t1/2 Mindre enn to timer.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Radium. Hentet fra: i.Wikipedia.org
- Redaktørene av Enyclopaedia Britannica. (2020). Radium. Gjenopprettet fra: Britannica.com
- Radioaktivitet. (s.F.). Radium: Den radioaktive kjernen som gjorde historien. Gjenopprettet fra: radioaktivitet.EU.com
- Cantrill, v. (2018). Radiums realiteter. Nature Chem 10, 898. gjør jeg.org/10.1038/S41557-018-0114-8
- Elsevier f.V. (2020). Radium. Scientedirect. Hentet fra: Scientedirect.com
- « Vind erosjonsfaktorer, typer, konsekvenser, eksempler
- Kursiv halvøya geografi, land, flora, fauna, klima »

