Endergonic reaksjon

- 4848
- 1020
- Markus Fredriksen
 En endær reaksjon er at ikke -spontan og som krever mye energi
En endær reaksjon er at ikke -spontan og som krever mye energi Hva er en endær reaksjon?
EN Endergonic reaksjon Det er en som ikke er spontan, og krever også høy energiforsyning. I kjemi er denne energien vanligvis kalori. De mest kjente blant alle endotermiske reaksjoner er endotermiske reaksjoner, det vil si de som absorberer varme for å oppstå.
Årsaken til at ikke alle reaksjoner er spontane er fordi de bruker energi, og systemene som dannes av artene som er involvert, reduserer deres entropi. Med andre ord, for kjemiske formål, blir de molekylær mer ryddig.
Å bygge en murvegg er et eksempel på en endelig reaksjon. Murstein alene er ikke kompakt nok til å danne en solid kropp. Dette er fordi det ikke er noen energiforsterkning som fremmer dens forening (også gjenspeiles i dets mulige lave intermolekylære interaksjoner).
For å bygge veggen trenger du sement og arbeidskraft. Dette er energi, og den ikke -spontane reaksjonen (veggen vil ikke bygges automatisk) blir mulig hvis en energifordel oppfattes (økonomisk, i tilfelle av veggen).
Hvis det ikke er noen fordel, vil veggen kollapse ved noen forstyrrelse, og mursteinene deres kan aldri holde seg forent. Det samme gjelder mange kjemiske forbindelser, hvis konstruksjonsblokker ikke kan bli med spontant.
Kjennetegn på en endarisk reaksjon
- Det er ikke spontan.
- Absorbere varme (eller annen type energi).
Årsaken er at produktene deres har mer energi enn reagensene som er involvert i reaksjonen. Ovennevnte kan representeres med følgende ligning:
Δg = gProdukter-GReagenser
Hvor Δg er endring av fri energi til Gibbs. Som gProdukt er større (fordi det er mer energisk) enn gReagenser, Subtraksjonen må være større enn null (ΔG> 0). Følgende bilde oppsummerer det nylig forklarte:
Kan tjene deg: natriumsulfat (Na2SO4): Struktur, egenskaper, bruksområder, innhenting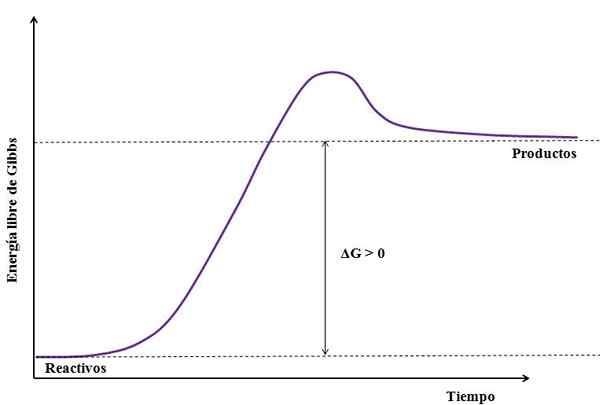 Figur av en endergonisk reaksjon. Kilde: Gabriel Bolívar
Figur av en endergonisk reaksjon. Kilde: Gabriel Bolívar Legg merke til forskjellen mellom energitilstander mellom produkter og reagenser (lilla linje). Derfor transformeres ikke reagensene til produkter (a+b => c) hvis det ikke er noen varmeabsorpsjon først.
Øk fri energi energi
Hver endergonisk reaksjon har en økning i systemfri energi i systemet. Hvis det for en viss reaksjon blir oppfylt at Δg> 0, vil den ikke være spontan og vil kreve at energiforsyningen skal utføres.
Hvordan vite matematisk om en reaksjon er endegonisk eller ikke? Bruke følgende ligning:
ΔG = ΔH-tΔS
Der ΔH er reaksjonens entalpi, det vil si den totale energien som frigjøres eller absorberes, ΔS er endringen av entropi, og T temperaturen. TΔS -faktoren er tap av energi som ikke er utnyttet i utvidelsen eller bestillingen av molekylene i en fase (fast, væske eller brus).
Dermed er ΔG energien som systemet kan bruke for å utføre en jobb. Ettersom ΔG har et positivt tegn for en endelig reaksjon, må energi eller arbeid (reagenser) brukes for å få produktene.
Så å kjenne ΔH -verdiene (positive, for en endoterm reaksjon og negativ, for en eksoterm reaksjon), og TΔS, kan du vite om reaksjonen er ende -gononisk.
Dette betyr at selv om en reaksjon er endotermisk, Nei Det er nødvendigvis endogonisk.
Ice Cube
For eksempel smelter en isbit i flytende vann som absorberer varme, som hjelper til med å skille molekyler; Prosessen er imidlertid spontan, og derfor er den ikke en endary reaksjon.
I tilfelle isen er grunnlagt ved en temperatur godt under -100 ° C, blir begrepet TΔs for den frie energiligningen lite sammenlignet med ΔH (fordi t reduseres), og som et resultat vil ΔG ha positiv verdi.
Kan tjene deg: karboksylsyreMed andre ord: Smelt isen under -100 ° C er en endegonisk prosess, og den er ikke spontan. En lignende sak er å fryse vann rundt 50 ° C, som ikke skjer spontant.
Koblingene til produktene deres er svakere
En annen viktig funksjon, også relatert til ΔG, er energien til nye koblinger. Koblingene til produktene som er dannet er svakere enn reagensene.
Nedgangen i koblingens kraft blir imidlertid kompensert med en massegevinst, noe som gjenspeiles i de fysiske egenskapene.
Her begynner sammenligningen med murveggen å miste betydningen. I følge det ovennevnte må stolpene inne i mursteinene være sterkere enn de mellom dem og sementen. Veggen som helhet er imidlertid mer stiv og motstandsdyktig mot større masse.
Det er kombinert med eksergoniske reaksjoner
Hvis slutten -talende reaksjoner ikke er spontan, hvordan finner de sted i naturen? Svaret skyldes kobling med andre reaksjoner som er ganske spontan (eksergonisk) og som på en eller annen måte fremmer deres utvikling.
For eksempel representerer følgende kjemiske ligning dette punktet:
A + B => C (Endergonic Reaction)
C + D => E (eksergonisk reaksjon)
Den første reaksjonen er ikke spontan, så naturlig nok kunne den ikke skje. Imidlertid tillater produksjonen av C den andre reaksjonen å oppstå, forårsaker og.
Legge til Gibbs gratis energier for de to reaksjonene, ΔG1 og Δg2, Med et resultat mindre enn null (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Det kan tjene deg: HydrorsHvis C ikke reagerte med D, kunne jeg aldri danne det, for ikke å ha energikompensasjon (som tilfelle av penger med murveggen). Det sies da at C og D "Jalan" til A og B for å reagere, til og med å være en endegonisk reaksjon.
Eksempler på endergoniske reaksjoner
Fotosyntese
Planter bruker solenergi for å lage karbohydrater og oksygen fra karbondioksid og vann. CO₂ og O2, Små molekyler med sterke koblinger, danner sukker, av Tarry -strukturer, som er tyngre, faste og smelter ved en temperatur rundt 186 ºC.
Merk at C-C-, C-H- og C-O-koblingene er svakere enn for O = C = O og O = O. Og fra en sukkerenhet kan planten syntetisere polysakkarider, for eksempel cellulose.
Syntese av biomolekyler og makromolekyler
Endermaniske reaksjoner er en del av anabole prosesser. I likhet med karbohydrater, krever andre biomolekyler, som proteiner og lipider, komplekse mekanismer som uten dem, og kobling med hydrolysereaksjonen til ATP, kunne det ikke være.
Dannelsen av diamanter og tunge forbindelser av råolje
Diamanter krever enormt trykk og temperaturer, slik at komponentene deres kan kompakte i et krystallinsk faststoff.
Noen krystalliseringer er imidlertid spontane, selv om de passerer i veldig langsomme hastigheter (spontanitet er ikke relatert til reaksjonens kinetikk).
Til slutt representerer råolje alene et produkt av endergoniske reaksjoner, spesielt tunge hydrokarboner eller makromolekyler som kalles asfalter.
Strukturen deres er veldig kompliserte, og syntesen deres trenger mye tid (millioner av år), varme og bakteriell virkning.
Andre eksempler
- Cellulær pust av planter.
- Transport av oksygen i blodomløpet.
- Diffusjonen av ioner gjennom cellemembraner.
- Muskelsammentrekning.
- Celleproteinsyntese.
Referanser
- Endermaniske og ekseroniske reaksjoner. Gjenopprettet fra Quimitube.com
- Gratis energi. Gjenopprettet fra Es.Khanacademy.org
- Definisjon av endergonisk reaksjon. Hentet fra biologi.nett

