Synkeregel eller maksimal mangfoldighet

- 4958
- 88
- Mathias Aas
Vi forklarer hva Hund -regelen eller prinsippet om maksimal mangfoldighet er, trinn for å anvende den og gi flere eksempler
 Kilde: Gabriel Bolívar
Kilde: Gabriel Bolívar Hva er vaskeregelen?
De Sinkregel, Også kalt maksimalt mangfoldighetsprinsipp for spinn, er det en empirisk regel som brukes til å skrive den absolutte elektroniske konfigurasjonen av de kjemiske elementene når de er i sin grunnleggende tilstand. Det vil si at det er en regel som hjelper til.
Sinks regel sier:
"... I et atom som er i dets grunnleggende tilstand, vil elektroner med samme energinivå bli distribuert på en slik måte at det er så mye som mulig av parallelle ryggrader".
Denne regelen tilsvarer et av de grunnleggende prinsippene for kvantemekanikk og nåværende atomteori. Det er veldig nyttig å forstå noen egenskaper til de forskjellige elementene, spesielt deres magnetiske egenskaper. Dette er fordi atomer blir tiltrukket eller frastøtt av magneter når de har forsvunnet elektroner i strukturen.
Hvor kommer vasken eller maksimal mangfoldsregel fra?
Atomiske spektre
Dette prinsippet ga først den tyske fysikeren Friedrich Hund i 1927. Sink studerte atomabsorpsjonsspektre, som tillater eksperimentelt måling av energien som elektroner absorberer når de blir utsatt for elektromagnetisk stråling av tilstrekkelig bølgelengde. Eksperimentelle observasjoner kunne bare forklares hvis atomet hadde så mye elektroner som mulig med samme spinn.
Manglende elektroner
I tillegg til atomspektrene, er det andre eksperimentelle observasjoner som bekrefter de elektroniske konfigurasjonene som er forutsagt ved å anvende HUN -regelen. Det viktigste består av eksperimentelle mål for de magnetiske egenskapene til atomer som tillater å bestemme hvor mange manglende elektroner som har et atom.
Det kan tjene deg: vannelektrolyseDe manglende elektronene er de som er alene i et orbital, uten deres respektive motsatte spinnpar.
Trinn for å bruke synkeregelen
Vaskeregelen gjelder når vi skriver den elektroniske konfigurasjonen av et atom i sin grunnleggende tilstand. Dette betyr at det er en utfyllende regel av andre regler, for eksempel Aufbau -prinsippet eller konstruksjonsprinsippet (også kalt Rain Rule) og prinsippet om ekskludering av Pauli.
Gjelder bare de tilfellene vi ønsker.
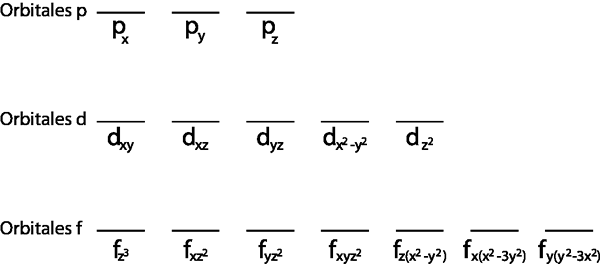
I tillegg er det bare fornuftig å bruke det på Valencia -laget, det vil si at energinivået som er ufullstendig (det har ikke alle elektronene som passer inn i det). Ellers ville alle elektronene bli sammenkoblet for å overholde Paulis eksklusjonsprinsipp.
Bruken av denne regelen består av følgende trinn:
- Trinn 1: Tegn en horisontal linje eller et lite rektangel for hver orbital i undernivået.
- Trinn 2: Plasser det første elektronet i første orbital med spinnet ditt peker opp.
- Trinn 3: Plasser følgende elektron i neste orbital, og pek også opp.
- Trinn 4: Fortsett slik til elektronene er over eller det ikke er flere tomme orbitaler.
- Trinn 5: Hvis det fremdeles skal distribueres når du plasserer et elektron i hver orbital.
For å forstå hvordan disse trinnene gjelder, la oss analysere et par eksempler.
Eksempel 1: Nitrogenelektronisk konfigurasjon
Nitrogen er element nummer 7, så det har totalt 7 elektroner som dreier seg rundt kjernen. Disse elektronene er distribuert som følger, etter regnregelen:
Kan tjene deg: Acetanylide (C8H9NO)1s2 2s2 2 s3
Som vi kan se, tilsvarer nitrogen valenselaget nivå 2 av energi (kalt lag L) der 8 elektroner passer. Imidlertid har nitrogen bare 5 Valencia -elektroner.
I orbitalene s Bare 2 elektroner passer, så 2S -orbitalen er helt full og gir ingen mening å anvende synkeregelen for denne orbitalen.
På den annen side er ikke 2p -undernivået, som inneholder 3 orbitaler, full. Men hvordan er disse 3 elektronene distribuert i de tre orbitalene? De er distribuert etter trinnene i synkeregelen, som er presentert nedenfor:
Trinn 1: Tegn en horisontal linje eller et lite rektangel for hver orbital i undernivået.
Siden det er 2p undernivå, er det tre orbitaler som er 2px, 2 sog og 2pz. Så vi må tegne tre horisontale striper eller tre bokser eller rektangler:
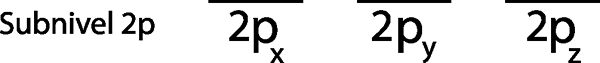
Hver av disse stripene eller boksene representerer en orbital, som indikert med navnet som har ned hver av dem.
Trinn 2: Plasser det første elektronet i første orbital med spinnet ditt peker opp.
Vi plasserer det første elektronet i 2P -orbitalenx Siden dette er den første orbitalen på listen.
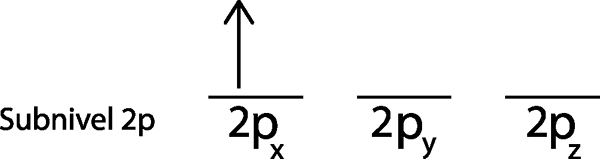
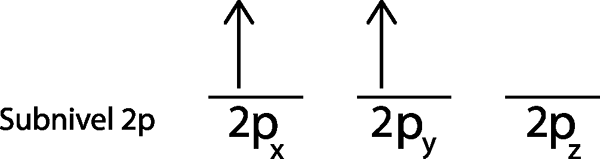
Trinn 3: Plasser følgende elektron i neste orbital, og pek også opp.
Det andre elektronet er lokalisert i 2P -orbitalenog
Trinn 4: Fortsett slik til elektronene er over eller det ikke er flere tomme orbitaler.
I vårt tilfelle må vi bare distribuere 3 elektroner, så vi trenger bare å plassere det siste elektronet i siste orbital og voila:
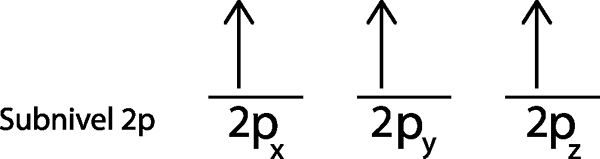
Som det kan sees, spår prinsippet om maksimal mangfoldighet eller synkeregel at atomisk nitrogen må ha 3 manglende elektroner.
Kan tjene deg: Nitrogenoksider (NOX)I dette tilfellet var det ikke nødvendig å bruke trinn 5, siden vi etter trinn 4 ble stående uten elektroner for å distribuere.
Eksempel 2: Jernelektronisk konfigurasjon
Jern er element 26 og dets elektroniske konfigurasjon er:
1s2 2s2 2 s6 3s2 3p6 3d6 4s2
I dette tilfellet kan vi merke oss at orbitalen med det høyeste energinivået er 4S, men fordi det er et overgangsmetall, har jern en delvis full orbital d. Dette er orbitalen hvis elektroner vi vil distribuere etter Hund -regelen.
Trinn 1: Tegn en horisontal linje eller et lite rektangel for hver orbital i undernivået.
Vi vil fylle 3D -undernivået som inneholder 5 orbitaler:
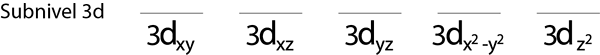
Trinn 2: Plasser det første elektronet i første orbital med spinnet ditt peker opp.
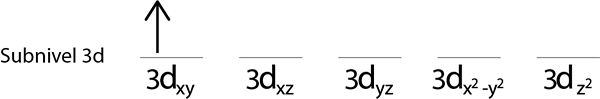
Trinn 3: Plasser følgende elektron i følgende orbital, og pek også opp.
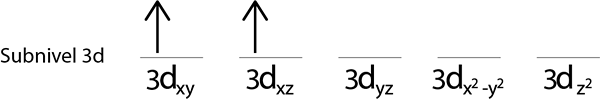
Trinn 4: Fortsett slik til elektronene er over eller det ikke er flere tomme orbitaler.
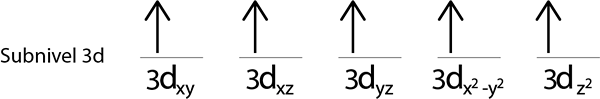
Trinn 5: Hvis det fremdeles skal distribueres når du plasserer et elektron i hver orbital.
Siden vi fremdeles har et elektron å distribuere etter å ha plassert et elektron i hver 3D -orbital, plasseres den siste av de 6 elektronene med motsatt spinn i den første orbitalen.
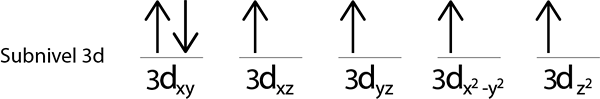
Dette er den absolutte konfigurasjonen av et jernatom i sin grunnleggende tilstand. På samme måte har jern 4 manglende elektroner med parallelle ryggrader.
Referanser
- Uten å svare på spørsmål om maksimal mangfoldighet eller synkeregel: Hva bør gjøres (2020). Hentet fra Physis andquimica.com.
- Sink - Kjemi (2021). Hentet fra kostnadsprosjekt.org.
- Maksimal mangfoldighet av Sind (2020). Hentet fra prinsippet.com.
- Synke regel | The Chemistry Guide (2012). Hentet fra kjemi.Laguia2000.com.

