Selenhistorie, egenskaper, struktur, innhenting, bruker

- 1746
- 28
- Thomas Karlsen
Han Selen Det er et ikke -metallisk kjemikalie som tilhører gruppe 16 i det periodiske tabellen og er representert med symbolet er. Dette elementet har mellomliggende egenskaper mellom svovel og Telurio, som er medlemmer av samme gruppe.
Selen ble oppdaget i 1817 av Jöhs J. Berzelius og John G. Gahn, som fordampet pyritten, observerte en rød rest (nedre bilde). Først forvirret de ham med Telurio, men innså deretter at de sto overfor et nytt element.
 En flaske med amorf rødt selen, det mest kjente alotropiske for dette elementet. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
En flaske med amorf rødt selen, det mest kjente alotropiske for dette elementet. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Berzelius kalte det nye elementet som Selenium, basert på navnet "Selene" som betyr "Moon Goddess". Selen er et essensielt spor for planter og dyr, selv om det i høye konsentrasjoner er et giftig element.
Selen har tre viktigste allotropiske former: rød, svart og grått. Sistnevnte har egenskapen til å endre sin elektriske ledningsbruk basert på intensiteten av lyset som utstråler det (Photoconductor), så det har hatt mange bruksområder.
Selen er vidt distribuert i jordskorpen, men mineralene som inneholder den er ikke rikelig, så det er ingen gruveutnyttelse av Selenium.
Det er hovedsakelig oppnådd som et sekundært produkt av raffineringsprosessen ved kobberelektrolyse. Selen akkumuleres i slimet som er ved anoden til elektrolyseceller.
Mennesker har rundt 25 seleenoproteiner, hvorav noen oppfyller en antioksidanthandling og kontrollerer generasjonen av frie radikaler. Det er også selenaminosyrer, for eksempel selenomeksjonin og selenocystein.
[TOC]
Historie
Første observasjon
Alchemisten Arnold of Villanova kan ha observert selen i 1230. Dette ble dannet i medisin i sorbonne i Paris, og var til og med doktoren i pave Clemente V.
Villanova i sin bok Rosarium Philosophorum Beskriv en rød svovel eller "svovel reboule" som hadde holdt seg i en ovn etter å ha fordampet svovelen. Denne røde svovelen kunne ha vært en alotropisk av selen.
Oppdagelse
I 1817 oppdaget Jöhs Jakob Berzelius og John Gottlieb Gahn Selenium i et kjemisk anlegg for produksjon av svovelsyre, nær gripsholm, Sverige. Råstoffet for utdyping av syren var pyritt, som hentet fra en Falun -gruve.
Berzelius ble rammet av eksistensen av en rød rest som forble i blybeholderen etter at svovelen hadde brent.
Berzelius og Gahn observerte også at den røde resten hadde en sterk lukt av krydret reddik, lik den som ble presentert av Telurio. Årsaken til at han skrev til vennen Marect at de trodde at den observerte avsetningen var en Telurio -forbindelse.
Imidlertid fortsatte Blelius å analysere det avsatte materialet ved å forbrenne pyritten og vurderte på nytt at Telurio ikke hadde blitt funnet i Falun. Konkluderte i februar 1818 at han hadde oppdaget et nytt element.
Opprinnelse til navnet ditt
Berzelius påpekte at det nye elementet var en kombinasjon av svovel og Telurio, og at likheten til Telurio med det nye elementet hadde gitt ham muligheten til å navngi det nye selenstoffet.
Berzelius forklarte at "tellus" betyr jordens gudinne. Martin Klaport i 1799 plasserte dette navnet Telurio og skrev: “Ingen elementer kalles bare på den måten. Det måtte gjøres!"".
På grunn av likheten til Telurio med det nye stoffet, kalte Berzelius det med ordet selen, avledet fra det greske ordet "Selene" som betyr "månens gudinne".
Utvikling av applikasjonene dine
I 1873 oppdaget Willoughby Smith at den elektriske konduktiviteten presentert av Selenium var avhengig av lyset som utstrålte det. Denne eiendommen tillot Selenium å ha mange applikasjoner.
Alexander Graham Bell i 1979 brukte selen i fotofonen. Selen produserer en elektrisk strøm proporsjonal med intensiteten til lyset som lyser den, ved å bruke i lette målere, sikkerhetsmekanismer for åpning og lukking av dører, etc.
Bruken av selen likerettere i elektronikk begynte fra 1930 -tallet, med mange kommersielle applikasjoner. På 1970 -tallet ble han erstattet i likeretterne for silisium.
I 1957 ble det oppdaget at selen var et essensielt element for pattedyrens liv, siden det var til stede i enzymer som beskytter mot reaktive oksygen- og frie radikaler. I tillegg ble eksistensen av aminosyrer som selenometionin oppdaget.
Fysiske og kjemiske egenskaper
Utseende
Det er flere alotroper for selen, deres fysiske utseende varierer. Det presenteres vanligvis som et rødlig fast stoff i form av støv.
Standard atomvekt
78.971 u
Atomnummer (z)
3. 4
Smeltepunkt
221 ºC
Kokepunkt
685 ºC
Tetthet
Selen tetthet varierer avhengig av hvilken alotropisk eller polymorf som blir vurdert. Noen av dens bestemte tettheter ved romtemperatur er:
Grå: 4.819 g/cm3
Alfa: 4,39 g/cm3
Glass: 4,28 g/cm3
Flytende tilstand (smeltepunkt): 3,99 g/cm3
Fusjonsvarme
Grå: 6,69 kJ/mol
Fordampningsvarme
95,48 kJ/mol
Molar kalorikapasitet
25,363 J/(mol · K)
Oksidasjonstall
Selen kan kobles sammen i forbindelsene som manifesterer følgende tall eller oksidasjonstilstander: -2, -1, +1, +2, +3, +4, +5, +6. Blant dem er de viktigste -2 (2-), +4 (jeg vet4+) og +6 (jeg vet6+).
Kan tjene deg: enkelt mikroskopFor eksempel i SEO2 Selen har +4 oksidasjonsnummer; det vil si at eksistensen av kationen antas4+ (HAN4+ENTEN22-). Ligner på SEO3 Selen har +6 oksidasjonsnummer (i6+ENTEN32-).
I hydrogen seleniuro, h2SE, selen har oksidasjonsnummer på -2; Det vil si igjen, eksistensen av ion eller anion antas å2- (H2+HAN2-). Dette er fordi selen er mer elektronegativ enn hydrogen.
Elektronegativitet
2.55 på Pauling -skalaen.
Ioniseringsenergi
-Først: 941 kJ/mol.
-For det andre: 2.045 kJ/mol.
-Tredje: 2.973,7 kJ/mol.
Magnetisk ordre
Diamagnetisk.
Hardhet
2.0 på MOHS -skalaen.
Isotoper
Det er fem naturlige og stabile isotoper av selen, som er vist nedenfor med deres respektive forekomster:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Allotropy
 Svart flaske belagt med en tynn film av selengrå. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Svart flaske belagt med en tynn film av selengrå. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Selen som er fremstilt i kjemiske reaksjoner er et mursteinrødt amorft pulver, som når den glassfulle svarte formen er grunnlagt, ligner Rosario -kontoer (overlegen bilde). Svart selen er et sprøtt og skinnende fast stoff.
I tillegg er svart selen litt løselig i karbonsulfid. Når denne løsningen blir oppvarmet ved 180 ºC, utløser det grå selen, dets mest stabile og tette alotropiske.
Grått selen er motstandsdyktig mot oksidasjon og er inert til virkningen av ikke -oksidiserende syrer. Hovedegenskapen til dette selen er dens fotokonduktivitet. Å være opplyst øker den elektriske ledningsevnen med en faktor 10 til 15 ganger.
Reaktivitet
Selen i sine forbindelser eksisterer i oksidasjonstilstandene -2, +4 og +6. Manifesterer en klar tendens til å danne syrer i høyere oksidasjonstilstander. Forbindelsene som har selen med oksidasjonstilstand -2, kalles seleniuros (2-).
Hydrogenreaksjon
Selen reagerer med hydrogen for å danne hydrogen seleniuro (h2Se), en fargeløs, brennbar og stinkende gass.
Oksygenreaksjon
Selen brenner ved å avgi en blå flamme og danne selendioksid:
HAN8 (S) + 8 o2 => 8 SEO2 (S)
Selenoksyd er en polymer, hvitt og fast stoff. Hydrering produserer selenesyre (h2Seo3). Selen danner også selen trioxide (SEO3), Analog med svovel (så3).
Reaksjon med halogener
Selen reagerer med fluor for å danne selen heksafluoruro:
HAN8 (S) +24 F2 (g) => 8 SEF6 (L)
Selen reagerer med klor og brom for å danne henholdsvis diklorid og dysileniumdibromur:
HAN8 (S) +4 CL2 => 4 se2Cl2
HAN8 (S) +4 BR2 => 4 se2Br2
Selen kan også danne SEF4 og Secl4.
På den annen side danner selenforbindelsene der et atom av selen blir med i et av halogen og et annet av oksygen. Et viktig eksempel er selen oksyklorid (SEO2Cl2), Med selen i oksidasjon +6, et ekstremt kraftig løsningsmiddel.
Reaksjon med metaller
Selen reagerer med metaller for å danne aluminium, kadmium og natrium seleniuros. Kjemikaliet nedenfor tilsvarer dannelsen av aluminium Seleniuro:
3 Se8 + 16 Al => 8 til2HAN3
Selenitas
Selen danner salter kjent som selenitas; For eksempel: Sølv selenitt (AG2Seo3) og natrium selenitt (Na2Seo3). Dette navnet har blitt brukt, i en litterær sammenheng, for å referere til Moons innbyggere: Selenitas.
Syrer
Den viktigste selensyren er tetningsyre (h2Seo4). Den er like sterk som svovelsyre og reduseres lettere.
Elektronisk struktur og konfigurasjon
- Selen og dets koblinger
Selen har seks elektroner i Valencia, og det er derfor den ligger i gruppe 16, det samme som oksygen og svovel. Disse seks elektronene finnes i 4S og 4P orbitaler, i henhold til deres elektroniske konfigurasjon:
[AR] 3D10 4s2 4p4
Derfor, som svovel, danner derfor to kovalente bindinger for å fullføre oktetten av Valencia; Selv om det har tilgjengeligheten av 4D -orbitaler for å koble mer enn to atomer. Dermed nærmer tre selenatomer seg og danner to kovalente bindinger: Se-Se-Se.
Selen med sin større atommasse har en naturlig tendens til å danne strukturer styrt av kovalente bindinger; I stedet for å bli arrangert som diatomiske molekyler2, Se = se, analog med o2, O = O.
- Ringer eller kjeder
Blant molekylære strukturer som seles av selenatomer, kan to nevnes generelt: Ringer eller kjeder. Merk at i det hypotetiske tilfellet av SE3, Atomer er fremdeles påkrevd av endene; Derfor må de koble til andre atomer, suksessivt, til kjeden kan lukkes i en ring.
De vanligste ringene er de av åtte medlemmer eller selenatomer:8 (En selenittkrone). Hvorfor åtte? Fordi jo mindre ringen, desto større vil spenningen lide; Det vil si at vinklene på koblingene deres avviker fra de naturlige verdiene som er satt av deres SP -hybridiseringer3 (lignende som med cycloalcanos).
Kan tjene deg: Pascal sprøyteDet er åtte atomer, skillet mellom SE-atomene er nok til at koblingene deres er "avslappet" og ikke "brettet"; Selv om vinkelen på koblingene er 105,7 og ikke 109,5. På den annen side kan det være mindre ringer: i6 og7.
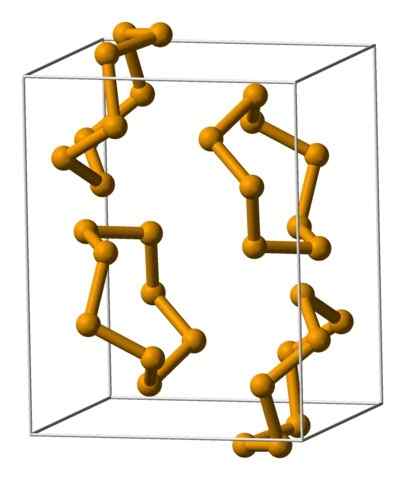 Selenanalærenheter representert med en modell av sfærer og barer. Kilde: Benjah-BMM27 [Public Domain].
Selenanalærenheter representert med en modell av sfærer og barer. Kilde: Benjah-BMM27 [Public Domain]. I det øvre bildet vises anialenhetene8. Legg merke til likheten de har med svovelkronene; Bare de er større og tunge.
I tillegg til ringene, kan selenatomer også være ordnet i spiralformede kjeder (tenk på snegletrapper):
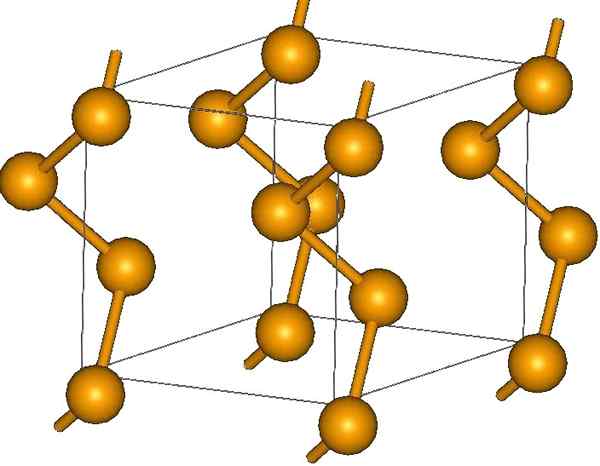 Heliske selenkjeder. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Heliske selenkjeder. Kilde: Materialscientist at engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] I endene kan det være dobbeltterminalkoblinger (-se = se), eller ringer er8.
- Alotropes
Når man tar hensyn til at det kan være selenes heliske ringer eller kjeder, og at dimensjonene deres også kan variere avhengig av antall atomer de inneholder, er det tydelig at det er mer enn ett alotropisk for dette elementet; Dette er rene selenfaststoffer, men med forskjellige molekylære strukturer.
Rød selen
Blant de mest fremtredende alotropene av selen har vi rødt, som kan presenteres som et amorf støv, eller som monokliniske og polymorfe krystaller (se bildet av ringene er8).
I det amorfe røde selen er strukturer uordnede, uten tilsynelatende mønstre; Mens du er i linsen, etablerer ringene en monoklinisk struktur. Det krystallinske rødt selen er polymorf, og har tre faser: α, β og γ, som er forskjellige i tettheter.
Svart selen
Strukturen til det svarte selen består også av ringer; Men ikke åtte medlemmer, men mange flere, det er opp til ringer på tusen atomer (1000). Det sies da at strukturen er kompleks og består av polymerringer; noen større eller små enn andre.
Når det er polymerringer i forskjellige størrelser, er det vanskelig å vente på en strukturell orden å etablere; Så det svarte selenet er også amorf, men i motsetning til det rødlige støvet som er nevnt ovenfor, har det glassaktig konteksturer, selv om det er sprøtt.
Grå selen
Og til slutt, av de enkleste alotropene i selen er grå, som skiller seg ut over andre ved å være den mest stabile under normale forhold, og også ha et metallisk utseende.
Krystallene deres kan være sekskantet eller trigonal, etablert av Londons spredningskrefter mellom deres polymere heliske kjeder (overlegen bilde). Vinkelen på koblingene er 130,1 º, noe som indikerer et positivt avvik fra de tetraedrale miljøene (med vinkler på 109,5 °).
Det er grunnen til at Selenium heliske kjeder gir inntrykk av å være "åpne". Som elukubrasjon blir atomene i denne strukturen konfrontert, så i teorien må det være en større overlapping av orbitalene sine for å lage kjørebånd.
Varme med økningen i molekylære vibrasjoner skader disse båndene når kjedene er uordnede; Mens energien til et foton direkte påvirker elektroner, spennende dem og fremmer transaksjonene deres. Fra denne visjonen er det "enkelt" å forestille seg fotokonduktivitet for selengrå.
Hvor er og produksjon
Selv om det er vidt distribuert, er Selenium et sjeldent element. Det er i innfødt tilstand assosiert med svovel og mineraler som Eucairita (Cuagse), Clustalita (PBSE), Naumanite (AG AG2SE), og Crookesite [(Cutiag)2HAN].
Selen blir funnet som en urenhet som erstatter svovel i en liten del av metall svoveløse mineraler; som kobber, bly, sølv, etc.
Det er jordsmonn der selen eksisterer i den oppløselige formen av selenat. Disse blir ført av regnens vann til elvene og derfra, mot havet.
Noen planter er i stand til å absorbere og konsentrere selen. For eksempel inneholder en kopp nøtter i Brasil 544 ug selen, en mengde som tilsvarer 777% av mengden selen som anbefales daglig.
Hos levende vesener finnes selen i noen aminosyrer, for eksempel: selenometionin, selenocystein og metylselenocystein. Selenocystein og selenitt reduseres til hydrogen seleniuro.
Kobberelektrolyse
Det er ingen gruveutnyttelse av selen. Det meste oppnås som et sekundært produkt av raffineringsprosessen ved kobberelektrolyse, og er i silten som samler seg i anoden.
Det første trinnet består av selen dioksidproduksjon. For dette behandles anodisk slank med natriumkarbonat for å produsere oksidasjon. Deretter tilsettes selenoksydet vann og det blir surgjort for å danne seleninsyre.
Til slutt er det selenesyre med svoveldioksid for å produsere dens reduksjon og oppnå elementær selen.
I en annen metode i blandingen av silt og gjørme dannet i produksjonen av svovelsyre, oppnås et uren rød selen som løses opp i svovelsyre.
Selenesyre og sellensyre dannes deretter. Denne selen syren får den samme behandlingen som den forrige metoden.
Klor kan også brukes, som virker på metall selenuros for å produsere flyktige selenklorerte forbindelser; Slik som: Jeg vet2Cl2, Secl4, Secl2 og seokl2.
Kan tjene deg: kjemisk nivåDisse forbindelsene, i en prosess utført i vannet, blir selenesyre, som blir behandlet med svoveldioksid for å frigjøre selen.
Biologisk papir
Mangel
Selen er et essensielt spor for planter og dyr, hvis mangel hos mennesker har forårsaket alvorlige lidelser som Keshans sykdom; En sykdom preget av myokardskader.
I tillegg er selenmangel assosiert med mannlig infertilitet og kan spille en rolle i Kashin-Becks sykdom, en type slitasjegikt. På samme måte er det observert en selenmangel ved revmatoid artritt.
Enzymatisk kofaktor
Selen er en komponent av enzymer med antioksidantvirkning, for eksempel glutasjona peroksidase og tioresodoxinreduktase som virker ved eliminering av stoffer med reaktiv oksygen.
I tillegg er Selenium en kofaktor av skjoldbruskkjertelhormoner desiodinaser. Disse enzymene er viktige for å regulere funksjonen til skjoldbruskhormoner.
Bruken av selen er indikert i behandlingen av Hasimotos sykdom, en autoimmun sykdom med dannelse av antistoffer mot skjoldbruskkjertelceller.
Selen har også blitt brukt for å redusere de giftige effektene av kvikksølv, siden noen av dens handlinger utøves på selen -avhengige antioksidantenzymer.
Proteiner og aminosyrer
Mannen har omtrent 25 seleenoproteiner som utøver en antioksidantvirkning for beskyttelse mot oksidativt stress, initiert av et overskudd av reaktiv oksygenarter (ROS) og reaktive nitrogenarter (Ni).
Tilstedeværelsen av aminosyrer selenomethytheocin og selenocystein hos mennesker er blitt påvist. Selenctionine brukes som et kostholdstilskudd i behandlingen av selenmangeltilstander.
Risiko
En høy selenkroppskonsentrasjon kan ha mange skadelige effekter på helsen, og starter med sprø hår og sprø negler, på hudutslett, varme, hudødem og sterke smerter.
Når de arbeider med selen i kontakt med øynene, kan folk uttrykke ild, irritasjon og rive. I mellomtiden kan langvarig eksponering for en røyk med høyt seleninnhold forårsake lungeødem, hvitløksdepust og bronkitt.
I tillegg kan personen oppleve pneumonitt, kvalme, frysninger, feber, smerter i halsen, diaré og hepatomegali.
Selen kan samhandle med andre medisiner og kosttilskudd, for eksempel antacida, antineoplastiske medisiner, kortikosteroider, niacin og piller for prevensjon.
Selen har vært assosiert med økt risiko for å få hudkreft. I en studie av National Cancer Institute ble det påpekt at menn med høy selenkroppskonsentrasjon hadde dobbelt så sannsynlighet for å lide av aggressiv prostatakreft.
En studie indikerer at det daglige inntaket av 200 ug selen øker med 50% muligheten for å utvikle en type II -diabetes.
applikasjoner
Kosmetikk
Selen sulfid brukes i behandlingen av seborrhea, så vel som fet eller flass.
Leger
Det brukes som en alternativ medisin i behandlingen av Hasimotos sykdom, en autoimmun skjoldbruskkjertelsykdom.
Selen reduserer toksisiteten til kvikksølv, hvis en av dets giftige aktiviteter utøves på deoksidantenzymer, som bruker selen som en kofaktor.
Manganelektrolyse
Bruken av selenoksyd i manganelektrolyse reduserer kostnadene for teknikken betydelig, siden elektrisk forbruk reduseres.
Pigment
Selen brukes som pigment i malerier, plast, keramikk og glass. Avhengig av selen som brukes, varierer fargen på glasset fra en dyp rød til en lett appelsin.
Fotokonduktiv
På grunn av egenskapen til det grå selen ved å endre dens elektriske konduktivitet avhengig av intensiteten av lyset som stråler det, har selenet blitt brukt i fotokopier, fotokipere, fotometre og solceller.
Bruken av selen hos kopimaskiner var en av de viktigste selenapplikasjonene; Men utseendet til organiske fotoledere har redusert bruken.
Krystaller
Selen brukes til misfarging av glasset, som et resultat av tilstedeværelsen av jern som gir en grønn eller gul farge. I tillegg tillater det en rød farge på glass, avhengig av bruken du vil gi den.
Vulcanisering
Dietenio Dietenium brukes som et vulkaniserende middel av gummiprodukter.
Legeringer
Selen brukes i kombinasjon med vismut i messingen, for å erstatte bly; Veldig giftig element som har redusert bruken på grunn av anbefalingene fra helsebyråer.
Selen tilsettes lave konsentrasjoner til stål- og kobberlegeringer for å forbedre brukervennligheten av disse metallene.
Likerettere
Selen -likerettere begynte å bli brukt i 1933 til 1970 -tallet, da de ble erstattet av silisium med lave kostnader og høyere kvalitet.
Referanser
- Royal Australian Chemical Institute. (2011). Selen. [PDF]. Gjenopprettet fra: Raci.org.Au
- Wikipedia. (2019). Selen. Hentet fra: i.Wikipedia.org
- Sato Kentaro. (s.F.). Nye allotropes av hovedgruppeelementer. [PDF]. Hentet fra: Tcichemicals.com
- Dr. Deig Stewart. (2019). Selen element fakta. Chemicool. Gjenopprettet fra: Chemicool.com
- Robert c. Brazted. (28. august 2019). Selen. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Marques Miguel. (s.F.). Selen. Gjenopprettet fra: Nautilus.Fis.Uc.Pt
- Helmestine, Anne Marie, PH.D. (3. juli 2019). Selen fakta. Gjenopprettet fra: Thoughtco.com
- Lentech b. V. (2019). Periodebord: selen. Gjenopprettet fra: Lentech.com
- Tinggi u. (2008). Selen: dens rolle som antioksidant i menneskers helse. Miljøhelse og forhindre medisin, 1. 3(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Office of Dietary Supplements. (9. juli 2019). Selen: Faktaark for helsepersonell. National Institute of Health. Hentet fra: SDG.OD.NIH.Gov

