Krystallinsk faststoffstruktur, egenskaper, typer, eksempler

- 2103
- 182
- Theodor Anders Hopland
De Krystallinske faste stoffer De er de hvis mikroskopiske strukturer er bestilt og overholder et særegent mønster for et visst krystallinsk nettverk; For eksempel: kubikk, sekskantet, triklinisk, rhomboédrica, blant andre.
Det sies at disse faste stoffer eksisterer som krystaller, som viser fasetter og geometriske design som gjenspeiler hvor bestilt er inne. Andre eksempler på krystallinske faste stoffer er diamant, kvarts, antracen, tørris, kaliumklorid eller magnesiumoksyd.
 En kriminalitetskrystallinsk bar. Kilde: Pixabay.
En kriminalitetskrystallinsk bar. Kilde: Pixabay. Et par meget kjente krystallinske faste stoffer er sukker og salt (NaCl). Ved første øyekast har begge hvite krystaller; Men egenskapene er veldig forskjellige. Sukker er et molekylært krystallinsk fast stoff, mens salt er et ionisk krystallinsk fast stoff. Den første er sammensatt av sukrosemolekyler; Og den andre, av naioner+ og cl-.
Det øvre bildet lar deg skimte hvordan lyse sukkerkrystaller kan være. Saltkrystaller, men de er ikke langt etter. Selv om sukker og salt ser ut som brødre, er strukturene deres forskjellige: sukker, som blir sukrose, har en monoklinisk struktur; Mens salt, en kubikkstruktur.
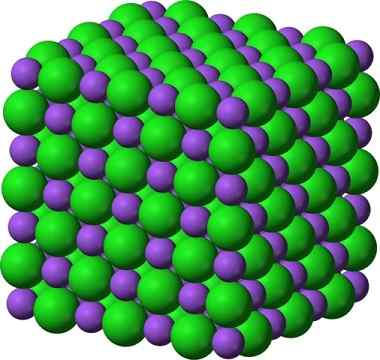 Krystallinsk struktur av natriumklorid, NaCl
Krystallinsk struktur av natriumklorid, NaCl Sprayet sukker og salt (Glas) forblir krystallinsk; Krystallene hans har bare blitt mye mindre for øynene våre. Krystalliniteten til et faststoff er derfor definert mer av dens indre struktur, enn av dets ytre utseende eller dets glitter.
[TOC]
Struktur av krystallinske faste stoffer
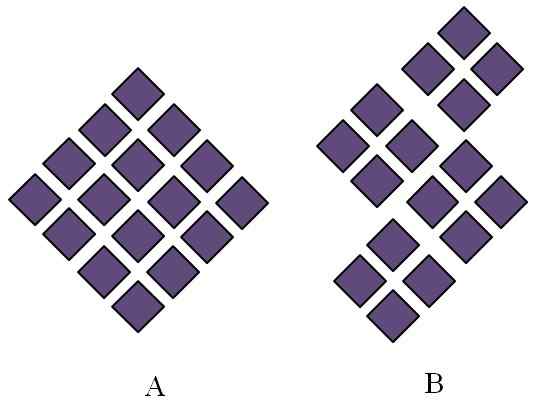 Bestilte strukturer av krystallinske faste stoffer. Kilde: Gabriel Bolívar.
Bestilte strukturer av krystallinske faste stoffer. Kilde: Gabriel Bolívar. Krystallinske faste stoffer har bestilt strukturer. Dets geometriske egenskaper vil avhenge av hvilken type krystallinsk nettverk de tilhører, som igjen er projisert eksternt i formene av krystallen (krystallinsk system). Det overlegne bildet illustrerer to viktige konsepter av slike strukturer: periodisitet og krystallinske korn.
Kan tjene deg: SpredningsfaseDet romlige systemet til partiklene til et krystallinsk fast stoff er avis; det vil si at det gjentas igjen og igjen i alle retninger. Dette forårsaker sitt eget strukturelle mønster for hvert solid og krystallinsk nettverk; For eksempel er det her salt og sukker begynner å skille utover den kjemiske naturen.
I Rhombuses blir de beordret til å gi opphav til en rhombus med større proporsjoner. Hver lilla rhombus representerer en partikkel eller et sett av dem (atomer, ioner eller molekyler). Dermed kan det forventes at en makroskopisk krystall av A har et rhomboédica -utseende.
I mellomtiden bestilles rhombuses i B på en slik måte at de stammer fra krystallinske korn; Dette er veldig små krystaller (krystallitter). Det sies da at B er et polyristisk fast stoff; det vil si at det dannes av agglomerasjonen flere krystallitter.
Avslutningsvis kan et fast stoff ganske enkelt være krystallinsk (A) eller polyristalin (B); I formkrystaller, mens B Polyristales.
Egenskaper
Egenskapene til krystallinske faste stoffer avhenger av dens glass type. Det er kjent at strukturene deres er bestilt, og at de også vanligvis presenterer strålende fraksjoner som blir forelsket i mineralelskere. Imidlertid ble det nevnt at en solid støvete, inkludert "off", også kan klassifiseres som krystallinsk.
Måten partiklene deres er romlig orientert, gjør at de har noen viktige egenskaper for deres karakterisering. For eksempel er krystallinske faste stoffer i stand til å diffrahere x -strømmer, og skaper diffraksjonsspektre som den mikroskopiske strukturen til en krystall kan bestemmes.
På samme måte, fordi strukturen er periodisk, formidles varmen på samme måte gjennom det faste stoffet; så lenge det ikke er noen urenheter i mellom. Dermed er smeltepunktene for et krystallinsk fast stoff konstant, og varierer ikke uavhengig av hvordan de måles.
Det kan tjene deg: Gallium: egenskaper, struktur, skaffelse, brukTyper krystallinske faste stoffer
Typene krystallinske faste stoffer er basert på hvilken type partikler som komponerer det og hva er deres interaksjoner eller lenker. Det er fire type: ioniske, metalliske, molekylære og kovalente nettverk.
Selv når de presenterer en viss grad av urenheter, fortsetter de å være krystallinske, selv om egenskapene deres påvirkes og ikke viser de samme forventede verdiene for et rent fast stoff.
Ionisk
Salt er et eksempel på et ionisk krystallinsk fast stoff, da det er sammensatt av Na -ioner+ og cl-. Derfor, i denne typen faste stoffer, styrer den ioniske bindingen: det er de elektrostatiske kreftene som styrer den strukturelle ordenen.
Metall
Alle metallatomer danner metallkrystaller. Dette betyr at for eksempel en sølvgaffel er et konglomerat av smeltede sølvkrystaller. Den indre eller mikroskopiske strukturen er den samme i hver håndflate, og forblir uendret fra gaffelen til gaffelen til tuppen av tennene.
Molekylær
Sukker er et eksempel på et molekylært krystallinsk fast stoff, ettersom det er dannet av sukrose molekyler. Derfor består denne typen faststoff av molekyler, som gjennom sine intermolekylære interaksjoner (og ikke -kovalente bindinger) klarer å etablere en ordnet struktur.
Kovalente nettverk
Endelig har vi de krystallinske faste stoffene i kovalente nettverk. De dominerer kovalente bindinger, siden de er ansvarlige for å etablere en ordre og opprettholde atomene sterkt fikset i sine respektive romposisjoner. Det er ingen snakk om ioner, atomer eller molekyler, men av tre -dimensjonale nettverk.
Eksempler
Neste, og til slutt, vil noen eksempler bli sitert for hver av de typer krystallinske faste stoffer.
Kan tjene deg: elektronegativitetIonisk
Alle salter er ioniske faste stoffer. Det er også sulfider, hydroksider, oksider, halogenider og andre forbindelser som også er dannet av ioner, eller deres interaksjoner er i ionisk essens. Vi har:
-KCl
-Sak4
-Ba (oh)2
-Cuso4
-FECL3
-Na2S
-Mgo
-Caf2
-Nahco3
-(NH4)2Cro4
I tillegg til disse eksemplene, regnes de aller fleste mineraler som ioniske krystallinske faste stoffer.
Metall
Ethvert metallisk element presenteres naturlig som metallkrystaller. Noen av dem er:
-Kobber
-Jern
-Aluminium
-Krom
-Metallisk hydrogen (under utenkelig trykk)
-Wolfram
-Zirkonium
-Titan
-Magnesium
-Natrium
Molekylær
Det er et bredt utvalg av molekylære krystallinske faste stoffer. Praktisk talt enhver organisk forbindelse som stivner klarer å etablere krystaller hvis renheten er høy, eller hvis strukturen ikke er for intrikat. Så vi har:
-Is (h2ENTEN)
-Dry Ice (CO2)
-Yo2
-P4
-S8 (og dens polymorfer)
-Antracen
-Fast oksygen
-Solid ammoniakk
-Phenolphthalein
-Benzosyre
Kovalente nettverk
Og til slutt, blant noen krystallinske faste stoffer i kovalente nettverk vi har:
-Diamant
-Grafitt
-Karbon nanorør
-Fullerenos
-Kvarts
-Silisium
-Germanium
-Bornitrid
Fra denne listen kan karbon nanorør og fulleren også betraktes som molekylære krystallinske faste stoffer. Dette er fordi de, selv om de består av kovalent forente karbonatomer, definerer de enheter som kan visualiseres som makromolekyler (fotballkuler og rør).
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Krystall. Hentet fra: i.Wikipedia.org
- Kjemi librettexts. (16. juni 2019). Krystallinske og amorfe faste stoffer. Gjenopprettet fra: Chem.Librettexts.org
- Rachel Bernstein & Anthony Carpi. (2020). Egenskaper til faste stoffer. Gjenopprettet fra: Visionlearning.com
- « Amorfe faststoffstruktur, egenskaper, eksempler
- Demografiske eksplosjonsårsaker, konsekvenser, fordeler, ulemper »

