Amorfe faststoffstruktur, egenskaper, eksempler

- 2609
- 453
- Anders Mathisen
De amorfe faste stoffer De er de som ikke har en ordnet langstruktur. De er det motsatte av det som er kjent av et krystallinsk fast stoff. Partiklene deres er assosiert på en rotete måte, lik væsker, men med tilstrekkelig kraft til samhold i en fast struktur.
Denne amorfe karakteren er mer vanlig enn man kunne tro; Det er faktisk en av de mulige tilstandene at den kondenserte saken kan ta i bruk. Dette forstår at enhver forbindelse som er i stand til å stivne og derfor krystalliserer, også kan festes på en uordnet måte hvis eksperimentelle forhold tillater det.
 Sukker bomull er et eksempel på et solid amorf. Kilde: Pixabay.
Sukker bomull er et eksempel på et solid amorf. Kilde: Pixabay. Ovennevnte brukes vanligvis på rene stoffer, enten elementer eller forbindelser. Men det er også gyldig når det gjelder blandinger. Mange faste blandinger er amorfe, som med bomull av sukker, sjokolade, majones eller potetpuré.
Det som et fast stoff er amorf, gjør det ikke mindre verdifullt enn en krystallinsk. Strukturforstyrrelsen gir den noen ganger unike egenskaper som ikke vil utvise i en krystallinsk tilstand. For eksempel er amorft silisium foretrukket i fotovoltaisk industri før linsen for visse småskala applikasjoner.
[TOC]
Struktur av amorfe faste stoffer
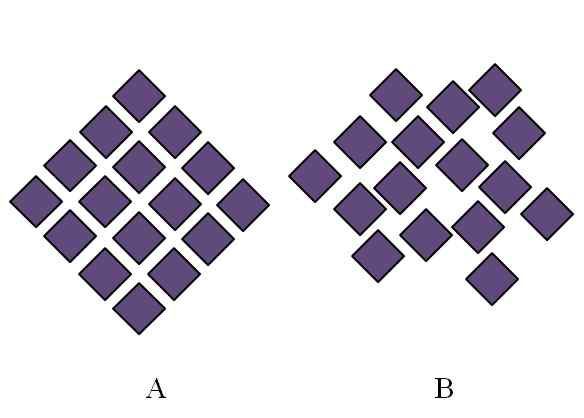 Forskjell mellom en krystallinsk struktur og en amorf struktur. Kilde: Gabriel Bolívar.
Forskjell mellom en krystallinsk struktur og en amorf struktur. Kilde: Gabriel Bolívar. Strukturen til et amorft faststoff er rotete; Det mangler periodisitet eller et strukturelt mønster. Det overlegne bildet illustrerer dette poenget. Det tilsvarer et krystallinsk fast stoff, mens B representerer et solid amorf. Merk at i B er lilla rhombuses vilkårlig arrangert, selv når både i og B er samme type interaksjoner.
Kan tjene deg: Phenolphthalein (C20H14O4)Hvis B også sees, vil det sees at det er rom som ser ut til å være tomme; det vil si at strukturen presenterer mangler eller uregelmessigheter. Derfor skyldes en del av den mikroskopiske eller indre lidelsen av et amorft fast stoff at dens partikler "rommer" på en slik måte at den resulterende strukturen har mange ufullkommenheter.
Til å begynne med ble omfanget laget i graden av bestilling av amorfe faste stoffer. I B er det knapt et par rhombuses som virker i orden. Det kan være bestilte regioner; Men bare i kort rekkevidde.
Det sies da at et amorft fast stoff er laget av umålelige krystaller bittesmå av forskjellige strukturer. Summen av alle disse strukturene ender opp med labyrint og meningsløs: Den globale strukturen blir amorf, sammensatt av en rekke krystallinske blokker spredt overalt.
Egenskaper
Egenskapene til et amorf faststoff varierer avhengig av arten av dens konformede partikler. Imidlertid er det visse generelle egenskaper som kan nevnes. Amorfe faste stoffer kan være glasslegeme når de har aspekter som ligner krystaller; eller gelé.
Å være deres rotete strukturer genererer ikke pålitelige røntgendiffraksjonsspektre. Smeltepunktene er heller ikke presise, men dekker et intervall av verdier.
For eksempel kan smeltepunktet for et amorft faststoff variere fra 20 til 60 ºC. I mellomtiden smelter krystallinske faste stoffer ved en spesifikk temperatur, eller i et smalt intervall hvis de inneholder mange urenheter.
Et annet kjennetegn ved amorfe faste stoffer er at når de går i stykker eller brudd, forårsaker de ikke geometriske og flate ansikter, men uregelmessige fragmenter med buede ansikter. Når de ikke er glasslegemer, blir de presentert som støvete og ugjennomsiktige kropper.
Det kan tjene deg: Alilo: Allyic Unit, Carbocation, Radical, EksemplerForberedelse
Mer enn et amorf faststoff er det praktisk å takle dette konseptet som en 'amorf tilstand'. Alle forbindelser (ionisk, molekylær, polymer, metallisk osv.) De er til en viss grad dyktige, og hvis de eksperimentelle forholdene lar det danne amorfe og ikke -krystallinske faste stoffer.
For eksempel i organisk syntese oppnås faste forbindelser i begynnelsen som støvete masser. Dets urenheters innhold er så høyt at disse påvirker dens molekylære rekkefølge. Det er grunnen til at når produktet rekrypteres igjen og igjen, blir faststoffet stadig mer krystallinsk; mister sin amorfe karakter.
Dette betyr ikke at amorfe faste stoffer nødvendigvis er uren materialer; Flere av dem er amorfe for sin egen kjemiske natur.
Et rent stoff kan stivne amorfisk hvis væsken din avkjøles skarpt, slik at partiklene deres ikke krystalliseres, men vedtar en glassskifting. Kjøling er så raskt at partikler ikke har nok tid til å imøtekomme de krystallinske blokkene som knapt er "født".
Vann er for eksempel i stand til å eksistere i glassaktig tilstand, amorf og ikke bare som is.
Eksempler på amorfe faste stoffer
Mineraler og plast
 Obsidian er en av de få amorfe mineralene som er kjent. Kilde: Pixabay.
Obsidian er en av de få amorfe mineralene som er kjent. Kilde: Pixabay. Praktisk talt ethvert krystallinsk materiale kan tilpasse seg en amorf form (og omvendt). Dette skjer med noen mineraler, som av geokjemiske grunner ikke formelt kunne etablere sine konvensjonelle krystaller. Andre derimot danner ikke krystaller, men glass; Slik er tilfellet med obsidian.
På den annen side har polymerer en tendens til å stivne amorfisk, siden molekylene deres er for store til å definere en ordnet struktur. Her er harpiks, gummi, polystyrenskum (anime), plast, teflon, Baquelita, blant andre.
Kan tjene deg: estereBiologisk vev
Biologiske faste stoffer er stort sett amorfe, for eksempel: orgelvev, hud, hår, hornhinne, etc. Også fett og proteiner danner amorfe masser; Imidlertid, med tilstrekkelig preparat, kan de krystallisere (DNA -krystaller, proteiner, fett).
Glass
 Glass, et amorft fast stoff
Glass, et amorft fast stoff Selv om det er nesten sist, er det mest representative amorfe faststoffet langt selve glasset. Komposisjonen i essensen er den samme som kvarts: SIO2. Både kvartskrystall og glass er tre -dimensjonale kovalente nettverk; Bare glassnettet er rotete, med si-eller lenker med forskjellige lengder.
 Metallisk glassprøve
Metallisk glassprøve Glass er den amorfe solide par excellence, og materialene som får et lignende utseende sies å ha en glassaktig tilstand.
Karbon og metaller
Vi har amorft karbon, og er den karbonaktiverte en av de viktigste for dets absorberende evner. Det er også silisium og Tyskland amorfe, med elektroniske applikasjoner der de fungerer som halvledere.
Og til slutt er det amorfe legeringer, at de på grunn av ulikheten i deres konformede metallatomer ikke etablerer en krystallinsk struktur.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Rachel Bernstein & Anthony Carpi. (2020). Egenskaper til faste stoffer. Gjenopprettet fra: Visionlearning.com
- Wikipedia. (2020). Amorf faststoff. Hentet fra: i.Wikipedia.org
- Richard Zallen, Ronald Walter Douglas og andre. (31. juli 2019). Amorf faststoff. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Elsevier f.V. (2020). Amorf faststoff. Scientedirect. Hentet fra: Scientedirect.com
- Danielle Reid. (2020). Amorf fast: definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com
- Rubiks kubekunstverk. (2008). Hva er et amorft materiale? Hentet fra: Web.Fysikk.UCSB.Edu
- « Sosial rollebegrep i henhold til Talcott Parsons, typer og eksempler
- Krystallinsk faststoffstruktur, egenskaper, typer, eksempler »

