Hypertonisk løsning
- 2255
- 579
- Magnus Sander Berntsen
Vi forklarer hva hypertoniske løsninger er, deres egenskaper, hva er bruk, forskjellene med hypotonikken og gir flere eksempler
Mange vil bli overrasket over å vite at måten planter absorberer vann gjennom røttene og måten fingrene på hendene rynker når de bader i sjøvann, de er nært beslektede.
Begge tingene skjer takket være eksistensen av en membran som fungerer som et filter, og en hypertonisk løsning som bokstavelig talt suger vann gjennom den. Men hva er en hypertonisk løsning?
I denne artikkelen vil dette spørsmålet bli besvart, og de mest relevante egenskapene til hypertoniske løsninger vil også bli presentert, hva de er for, hvordan de skiller seg fra andre typer løsninger og noen eksempler på det samme.
Hva er en hypertonisk løsning?
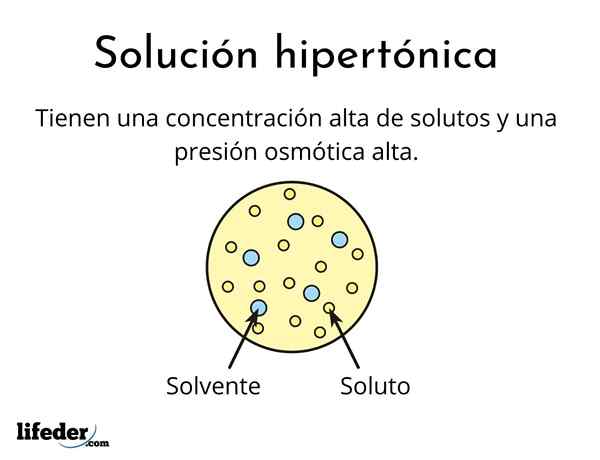
EN hypertonisk løsning Det er en som inneholder en total konsentrasjon av osmololar aktive oppløste løsninger enn den for en annen referanseløsning. Osmolarily aktiv betyr at løsninger ikke kan krysse en spesiell type membran (ligner på et stoff) som fungerer som en sil eller filter, det vil si la vannet passere og ikke til løst partikler.
Denne høye konsentrasjonen av oppløsninger får hypertoniske løsninger til å ha høyt osmotisk trykk. Dette trykket er det som praktisk talt suger vannet gjennom membranen, som kalles osmose.
Det hypertoniske ordet kommer fra det greske prefikset hyper-, som betyr "på, eller over" og "toner", som betyr spenning, eller trykk, så hypertonisk betyr bokstavelig talt "at det har større trykk eller spenning".
Det er viktig å huske på at i biologi og medisin, forutsatt at det er snakk om hypertonisk løsning, refererer det til en løsning som er mer konsentrert enn løsningen i blod, som kalles blodplasma.
Kjennetegn på hypertoniske løsninger
Hypertoniske løsninger har noen grunnleggende egenskaper:
De er dannet av et løsningsmiddel og minst ett oppløst
Ikke noen løsning kan være hypertonisk, selv om den er veldig konsentrert. Oppløsningen må ikke være i stand til å krysse membranen, mens vannet må kunne passere det uten problemer, ellers genereres ikke det osmotiske trykket.
De har høye konsentrasjoner av oppløste stoffer
Dette er det som gjør dem til hypertoniske løsninger. Som nevnt for et øyeblikk siden, er hypertoniske løsninger mer konsentrert enn blod.
Det kan tjene deg: brøkdestillasjon: prosess, utstyr, applikasjoner, eksemplerDe kan ha forskjellige komposisjoner
En hypertonisk løsning kan inneholde et enkelt oppløst stoff som salt, eller kan inneholde en blanding av oppløste stoffer som salter og sukker, for eksempel.
Solutoer kan være ioniske, nøytrale eller begge deler
Salg inneholder ioner med elektriske ladninger som ikke lar dem krysse membranen, så de er små. Andre oppløste stoffer har ingen ioner, men de er store og fete og passer ikke gjennom hullene.
De har høyt osmotisk trykk
Som nevnt ovenfor har hypertoniske løsninger et osmotisk trykk større enn blod.
De kan dehydrere celler
Hypertoniske løsninger trekker ut vannet fra celler som etterlater dem som rosiner. Det er grunnen til at hendene og føttene våre rynker når vi bader på stranden.
Hva er hypertoniske løsninger for?
Hypertoniske løsninger har mange bruksområder i dagliglivet, og også innen medisin. Noen av de vanligste bruksområdene er:
De brukes til å beholde mat
- Eksempel: Ferskenene i sirup ikke råtner fordi sirupen har mye oppløst sukker og er en veldig hypertonisk løsning. Ved å dehydrere celler tillater ikke hypertoniske løsninger sopp og bakterier i maten, fordi de dør av tørst. Dette lar matvare vare mer.
De tjener til å redusere betennelse
- Eksempel: Når noen har en ulykke og treffer hodet, er det mange ganger en betennelse i hjernen. For å kurere pasienten, injiserer legene en 7,5% saltløsningsløsning. Denne løsningen suger praktisk talt vann, og reduserer betennelsen i hjernen.
De tjener til å erstatte elektrolytter.
- Eksempel: Natrium er en elektrolytt som vi trenger å leve, og når en pasient har lite natrium i blodet, blir en 7,5% saltoppløsning injisert for å fylle på natriumet som gikk tapt.
De brukes til parenteral mat
- Eksempel: Når folk ikke kan spise gjennom munnen eller gjennom et rør, lever de i en hypertonisk løsning som inneholder en type sukker som kalles glukose.
Forskjeller med hypotoniske og isotoniske løsninger
Akkurat som det er hypertoniske løsninger, er det også hypotoniske og isotoniske løsninger. Forskjellen mellom sistnevnte og hypertoniske løsninger er konsentrasjonen. Hypotoniske løsninger er de som er mindre konsentrert enn blod, og isotonisk har samme konsentrasjon som blod.
For eksempel er rent vann, ettersom det ikke har noe løst, hypoton, mens kokosnøttvann har salter og sukker med en konsentrasjon nesten lik blodet, så det er isotonisk.
I tillegg til å differensiere etter konsentrasjon, er hyper-, hypo- og isotoniske løsninger forskjellige i måten de påvirker celler.
Følgende bilde viser effekten av de forskjellige typene løsninger på røde blodlegemer (de små cellene som gjør blodet rødt).
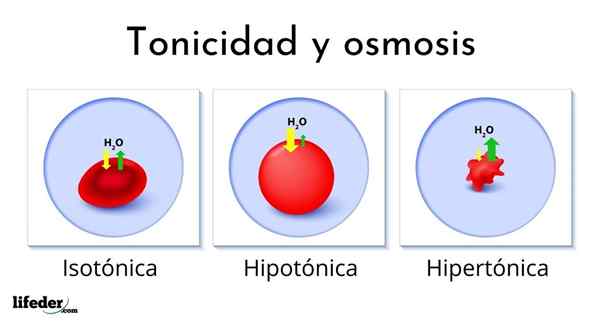
Hvis røde blodlegemer blir introdusert i en hypertonisk løsning, trekker den ut vannet, dehydrerer dem og lar dem rynkete som en passering.
På den annen side, hvis de blir introdusert i en hypotonoppløsning, absorberer røde blodlegemer vann og svulmer, til og med sprekker som en ballong som blåser for mye. Til slutt, hvis de blir introdusert i en isotonoppløsning, vil vann i og utenfor de røde blodcellene være i balanse, så ingenting skjer.
Eksempler på hypertoniske løsninger
Sukker sirup
 Fersken i sirup
Fersken i sirup Sirupen der fersken og annen frukt er bevart inneholder veldig høye sukkerkonsentrasjoner, så det er en hypertonisk løsning.
Saltlaken
Saltlaken er en løsning av vann og salt med veldig høye konsentrasjoner på mellom 3,5% og 25%, som kan bli nesten 30 ganger mer konsentrert enn blod (det vil si at den er veldig hypertonisk).
Eddik
En vanlig eddik er en hypertonisk løsning, siden den har en konsentrasjon på mellom 3% og 5% eddiksyre. Reduksjoner av balsamico eddik er enda mer konsentrert.
Kan tjene deg: Dimethylamine ((CH3) 2NH): Struktur, egenskaper, bruksområder, risikoDet samme blodet på venene våre, etter å ha svettet mye.
Når du trener og svetter, eliminerer kroppen vann og salter, men eliminerer mer vann enn salter (svette er hypotonisk), så blodet konsentrerer og blir hypertonisk.
Sjøvann
Sjøvann inneholder mange oppløste salter, med en total konsentrasjon på omtrent 3,5%, noe som gjør det hypertonisk. Det er grunnen til at sjøvann rynker fingrene.
Søte drikker
Cola -drinker og andre sukkerholdige drikker kan inneholde opptil 10% sukker, i tillegg til salter og andre oppløste stoffer med konsentrasjoner større enn blod.
5% dekstroseoppløsning og 0,45% natriumklorid (d5 ½ ns)
Dette er et eksempel på en hypertonisk løsning som brukes til å mate mennesker som normalt ikke kan spise ved munnen.
25% mannitol
Dette er en løsning som ofte brukes til å behandle sjokk på hodet. Det er fire ganger mer konsentrert enn blod.
7,5% saltoppløsning
Det er en ganske konsentrert saltløsning som også blir injisert med noen pasienter med visse sykdommer i venene.
Kommersielle juice
Alle saftene som er kjøpt i supermarkedet og som ikke er naturlige, har veldig høye sukkerkonsentrasjoner som gjør dem til hypertonisk.
Referanser
- Sweeney J. Håndtere hypernatremi. Sykepleie. September 2010; 40 (9): 63.
- Saltlake. Wikipedia. 2021. Tatt fra.Wikipedia.org/wiki/saltlake.
- Sjøvann. Wikipedia. 2021. Tatt fra.Wikipedia.Org/wiki/sjøvann.
- Chavaltamrong B, Pidatcha P, Thavisri U. Elektrolytter, sukker, kalorier, osmolaritet og pH i drikkevarer og kokosnøttvann. Sørøstasiatiske J Trop Med folkehelse. September 1982; 13 (3): 427-431.
- 5% dekstrose og 0.45% natriumkloridinjeksjon, USP. FDA. 2006. Hentet fra AccessData.FDA.GOV/Drugsatfda_Docs/Label/2006/017607S123LBL.PDF.
- Llorente G, Niño MC. Manitol versus hypertonisk saltoppløsning i nevroanestesi. Colombian Anesthesiology Magazine. Januar-mars 2015; 43 (1): 29-39.
- Hellige mm, e. Behandling av akutt vommen melkesyreose med intravenøs hypertonisk natriumklorid eller bikarbonatløsninger knullet av intrauminalt vann. Forskning i veterinærvitenskap. Februar 2020; 128: 24-34.
- Din-g. E, ABREU-C. JD, López-M. OG. Osmolalitet av hyppige forbruksdrikker. Klinisk forskning. Desember 2004; 45 (4).

