Støtdemperløsninger

- 2069
- 314
- Jonathan Carlsen
Vi forklarer hva som er dempeløsningene, deres egenskaper, komponenter, typer og gir flere eksempler
 Støtdabsorberende løsningene regulerer pH rundt en spesifikk verdi
Støtdabsorberende løsningene regulerer pH rundt en spesifikk verdi Hva er dempeløsninger?
De Støtdemperløsninger, Også kalt buffere, pH- eller buffersregulatorer, er vandige oppløsninger dannet av svak syre og dens konjugatbase eller en svak base og dens konjugerte syre.
De kalles støtdemperløsninger, siden de har evnen til å dempe endring av pH etter tilsetning av syrer eller baser i små mengder, selv om det er sterke syrer eller baser.
Støtdemningsløsningene er veldig nyttige, siden de lar pH -en være konstant. Det er mange kjemiske reaksjoner som trenger en spesifikk og konstant pH for å fungere godt.
Egenskapene til morpainary -løsningene
De er vandige oppløsninger
Både pH -konseptet og pH -skalaen gir bare mening i vandige oppløsninger, så alle buffere eller dempingsløsninger er fremstilt i vann.
Driften er basert på syre-base-likevekten og prinsippene for Le Chatlier
Buffere er basert på reversible syre-/basedissosiasjonsreaksjoner som er i likevekt. Ved å tilsette sterke syrer eller baser til miljøet, blir denne balansen forstyrret, så systemet reagerer for å motvirke forstyrrelsen, etter prinsippene til Le Catelier. Slik klarer buffere å dempe de store endringene i pH.
PH-en din beregnes lett med Henderson-Haselbalch-ligningen
Uansett hvilken type støtdemperløsning, dens pH både før og etter å ha tilsatt små mengder sterke syrer eller baser, kan den beregnes ved hjelp av Henderson-Hohaselbalch-ligningen:
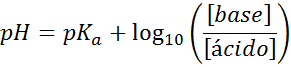
Hvor [base] refererer til den molære konsentrasjonen av basen (eller saltet av konjugatbunnen) og [syre] refererer til den molære konsentrasjonen av syren (eller saltet av den konjugerte syren).
Kan tjene deg: elastiske materialerDe er i stand til delvis å nøytralisere både syrer og baser
Dempeløsningene består av et grunnleggende stoff og et syrestoff, som kan nøytralisere baser og syrer, henholdsvis. Av denne grunn kan de dempe pH etter tilsetning av både sterke syrer og sterke baser.
Driften avhenger av temperaturen
PH i en bufferløsning avhenger av surheten eller den basiske konstanten til syren eller svake base som den inneholder. Denne konstanten avhenger av temperaturen, så driften av disse løsningene avhenger også av temperaturen.
Jo mer konsentrert, jo større er dens evne til å pute eller regulere pH
Dempekapasiteten avhenger av den totale konsentrasjonen av løsningen er større enn den endelige konsentrasjonen av syren eller sterk base som tilsettes. Av denne grunn, jo større er den totale konsentrasjonen av bufferløsningen, desto større er dens evne til pute syrer eller sterke baser.
Komponenter i en dempende eller bufferløsning
Kjemisk dannes dempingsløsninger av bare to komponenter. Disse komponentene kan være en svak syre blandet med et salt fra dens konjugatbase eller en svak base blandet med et salt av dens konjugerte syre.
Det er to forskjellige måter å skaffe disse komponentene i samme løsning, som vi vil se nedenfor:
1. Forberedelse av buffere som blander løsninger av komponentene
Dette er den mest direkte måten å fremstille en bufferløsning. For å gjøre dette er separate løsninger av svak syre (for eksempel eddiksyre) og et konjugatbasisalt (for eksempel natriumacetat) fremstilt separate løsninger). Da blandes begge løsningene gradvis til ønsket pH.
Det kan tjene deg: Ion Ammonium (NH4+): Formel, egenskaper og bruksområder
- Løsninger blandes litt etter litt til ønsket pH
2. Fremstilling av buffere ved delvis nøytralisering av en løsning av en svak syre
I dette tilfellet blir en svak syreoppløsning fremstilt med ønsket total konsentrasjon, og deretter tilsettes natrium- eller kaliumhydroksyd litt etter litt til de når ønsket pH.
Typer bufferløsninger
Støtdemperløsningene kan klassifiseres i henhold til hvilke typer komponenter de har eller i henhold til deres endelige pH.
I henhold til typer komponenter:
- Svak og konjugert basebuffer: I disse tilfellene avhenger pH av PKtil av svak syre.
- Svak grunnbuffer og konjugert syre: I disse tilfellene avhenger pH av PKb svak.
- Polyprotisk syresalter buffer: I noen tilfeller er både rollen som svak syre og dens konjugatbase begge salter fra delvis nøytralisering av en syre som har flere protoner som svovelsyre eller fosforisk.
I henhold til den endelige ph:
Avhengig av surhet eller basisk konstant, kan en bufferløsning regulere pH rundt forskjellige pH -områder, noe som gir opphav til tre typer buffere:
- Syrebuffere: Er de som regulerer pH rundt verdier lavere enn 7. De er tilberedt med svake syrer hvis PKtil være mindre enn 7 eller med svake baser hvis PKb være større enn 7.
- Nøytrale buffere: Er de som regulerer pH rundt 7. De består vanligvis av svake syrer eller baser som har en PKtil eller en PKb nær 7.
- Alkaliske buffere: Er de som regulerer pH rundt verdier større enn 7. De er tilberedt med svake syrer hvis PKtil være større enn 7 eller med svake baser hvis PKb er mindre enn 7.
Eksempler på buffere eller dempeløsninger
Eddiksyrebuffer/natriumacetat
Dette er en buffer av en svak syre (eddiksyre) og et salt av den konjugatbunnen (natriumacetat). Balansen involvert og dens likevektskonstant er:
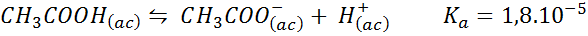
Denne bufferen regulerer pH rundt 4.74.
Ammoniakkbuffer/ammoniumklorid
Dette er en svak basebuffer (ammoniakk eller ammoniumhydroksyd) og et salt av dens konjugerte syre (ammoniumklorid). Balansen involvert og dens likevektskonstant er:
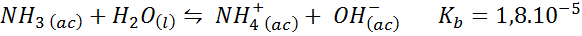
Dette er en alkalisk buffer som regulerer pH rundt 9.26.
Bisulfat/sulfatbuffer
I dette tilfellet spiller bisulfasjonen ionet papiret med svak syre hvis konjugatbase er sulfateionen. Balansen som er involvert er:
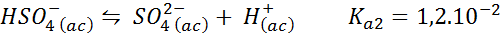
Dette er en surdaming -løsning som regulerer pH rundt 3.05.
Kullsyre/bikarbonatbuffer
Dette er et av de viktigste pH -reguleringssystemene i blodet vårt. Reaksjonen som er involvert er: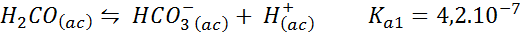
Denne bufferen regulerer pH rundt 6.38.
Dihydrogenbuffer fosfat/hydrogenfosfat
Dette er et av de mest brukte pH -reguleringssystemene innen biologi og biokjemi, siden det gjør det mulig å regulere pH -pH veldig nær den fysiologiske pH som de fleste kjemiske reaksjoner i celler oppstår. Reaksjonen er:
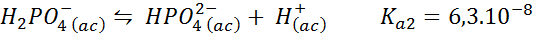
Denne bufferen regulerer pH rundt 7.20.

