Aluminiumsulfat (AL2 (SO4) 3)

- 2986
- 697
- Anders Mathisen
 Hvite aluminiumsulfatkrystaller
Hvite aluminiumsulfatkrystaller Hva er aluminiumsulfat?
Han Aluminiumsulfat Det er en uorganisk formel aluminiumsalt til2(SW4)3, som vanligvis forekommer som et hvitt fast stoff av skinnende krystaller. Fargen på forbindelsen vil bli påvirket av dens konsentrasjon av jern og annen urenhet. Det er to hovedtyper av aluminiumsulfat: A og B.
Det er et veldig løselig salt salt, og i naturen er det sjelden å finne det i sin vannfrie form. Det er vanligvis hydrert i form av oktadekahydrat aluminiumsulfat [til2(SW4)3.18H2Eller] eller heksadekahydrat [til2(SW4)3.16H2ENTEN].
Det kan også danne doble salter med kalium, og med ammonium, forbindelser kjent som lys. Delvis kan dette skyldes vannets affinitet inne i hydratene for å beholde andre ioner, i tillegg til aluminium.
Kjemisk struktur av aluminiumsulfat
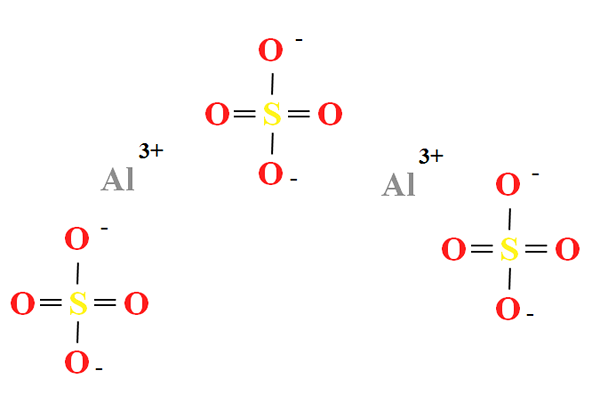 Kjemisk struktur av aluminiumsulfat. Kilde: Gabriel Bolívar
Kjemisk struktur av aluminiumsulfat. Kilde: Gabriel Bolívar Aluminiumsulfat har en andel av to kationer til3+ for hver tredje anion så42- (overlegen bilde), som kan observeres direkte i dens kjemiske formel til2(SW4)3.
Noter det3+ De er gråaktige, mens SOS42- De er gule (for svovelatom) og rødt (av oksygenatomer).
Den illustrerte strukturen tilsvarer den vannfrie formen av Al2(SW4)3, Siden ingen vannmolekyl interagerer med ionene. I hydratene kan imidlertid vann tiltrekkes av de positive sentrene i Al3+, eller for den negative tetrahedra av SO42- av hydrogenbroer (hah-o-so32-).
Al2(SW4)3∙ 18 timer2Eller for eksempel inneholder den 18 vannmolekyler i sin faste struktur. Noen av dem kan være i direkte kontakt med ham3+ eller med SOS42-. Med andre ord: aluminiumsulfat kan ha internt eller eksternt koordinasjonsvann.
Dessuten kan strukturen huse andre kationer som tro3+, Na+, K+, etc. Men for dette er tilstedeværelsen av mer under anioner nødvendig42-, å nøytralisere økningen i positive belastninger på grunn av metallforurensninger.
Aluminiumsulfat kan ha mange strukturer, selv om hydratene har en tendens til å ta i bruk det monokliniske krystallinske systemet.
Fysiske og kjemiske egenskaper
Aspekt
Det presenteres som et fast stoff med blinkende hvite krystaller, granuler eller støv.
Molekylær vekt
342,31 g/mol (vannfri).
Lukt
Det er toalett.
Smak
Søt smak, moderat snerpende.
Smeltepunkt
770º C Anhydra Form (86,5º C Octadecahydrat Form).
Vannløselighet
31,2 g/100 ml ved 0º C; 36,4 g/100 ml ved 20 ºC og 89 g/100 ml ved 100 ºC.
Tetthet
2,67 til 2,71 g/cm3.
Løselighet
Litt løselig i etylalkohol.
Damptrykk
I hovedsak null.
Stabilitet
Luft i luften.
Nedbrytning
Når den blir oppvarmet, omtrent til smeltepunktet, kan det brytes ved å avgi spesielt svoveloksid, en giftig gass.
Korrosivitet
Aluminiumsulfatløsninger er etsende for aluminium. Forbindelsen kan også korrodere metaller i nærvær av fuktighet.
Kan tjene deg: glukoneogenesePka
3.3 til 3.6. Og pH er 2,9 eller mer i en vandig løsning ved 5%.
Bruk av aluminiumsulfat
Vannkoagulering eller flokkulering
- Når du blandes med vann (drikke, serveres eller avfall), forårsaker aluminiumsulfat aluminiumhydroksyd, som danner kompleks med forbindelser og partikler i oppløsningen ved å akselerere dens sedimentasjon, som i fravær av behandling med aluminiumsulfat ville ta sent lang tid.
- Aluminiumsulfat brukes også til å rengjøre bassengvannet, noe som gjør dem mer attraktive å bruke.
- Gjennom bruk av aluminiumsulfat oppnås et vann uten turbiditet og farge, noe. Dessverre kan denne rensemetoden føre til en litt forsterket aluminiumskonsentrasjon i vannet.
- Aluminium er et veldig giftig metall som samler seg i hud, hjerne og lunger, noe som forårsaker alvorlige lidelser. I tillegg er det ikke kjent hvilken funksjon som oppfyller i levende vesener.
- EU krever at den maksimale tillatte grensen for aluminium i vannet ikke overstiger 0,2 mg/l. På den annen side krever det amerikanske miljøbeskyttelsesbyrået at den maksimale vannforurensningsgrensen med aluminium ikke overstiger 0,05-0,2 mg/l.
- Behandling av vann som brukes eller servert med aluminiumsulfat tillater eliminering eller reduksjon av fosfor i dem, økonomisk.
Jeg bruker som blekk mordant og i utdypingen av papiret
- Aluminiumsulfat har blitt brukt som en mordant av fargestoffer eller blekk, og hjelper til med å se på tekstilmateriale. Fikseringsaksjonen skyldes Al (OH)3, hvis gelatinøse konsistens samarbeider med adsorpsjonen av fargestoffer over tekstiler.
- Selv om det har blitt brukt fra omtrent 2000 til.C. Med det beskrevne formålet er det bare organiske fargestoffer som krever mordanter. Syntetiske fargestoffer, derimot, krever ikke at mordanter oppfyller sin funksjon.
- Den har blitt fortrengt fra papirproduksjon, men den brukes fremdeles i utdyping av papirmasse. Fjern urenhetene dine, så vel som de har blitt brukt til å koble materialer, nøytralisere belastninger og kalibrere kolofoni.
Industriell bruk
- Det brukes i byggebransjen for å få fart på konkrete omgivelser. I tillegg brukes det i vanntetting av konstruksjoner.
- I såper og fettindustri brukes den i glyserinproduksjon.
- I oljeindustrien, for utdyping av syntetiske katalysatorer de bruker under driften.
- Det brukes i legemiddelindustrien som en snerpende i utarbeidelsen av medisiner og kosmetikk.
- Griper inn i utdyping av fargestoffer som Carmine. Det brukes også som et fargestoff i produksjonen av syntetisk gummi -rumpe.
- I sukkerproduksjonsindustrien brukes den som en renser av sukkerrøret melasse.
- Det brukes til fremstilling av deodoranter, da det forårsaker innsnevring av kanalkanalene i svettekjertlene, og dermed begrenser akkumulering av svette, et middel som er nødvendig for veksten av bakteriene som forårsaker den dårlige lukten.
- Det brukes i lærstanning, en prosess som er nødvendig for bruk. I tillegg brukes det i fremstilling av gjødsel.
- Det brukes som tilsetningsstoff i utdyping av malerier, lim og fugemasse, samt rengjøring og omsorgsfulle møbler av møbler.
Medisin og terapeutisk bruk
- Aluminiumsulfat er en immunjuvans. Derfor oppfyller den funksjonen til å behandle antigenene på en slik måte at når de frigjøres i deres handlingssted, produserer de en større produksjon av antistoffer for antigenene som ble inokulert.
- Freund og BCG adjuvans, så vel som de andre adjuvannene, inkludert endogener som interleukins, er ikke -spesifikke for antigener, noe som tillater en økning i radius for immunhandling. Dette har tillatt utdyping av vaksiner mot mange sykdommer.
- Koagulerende virkning av aluminiumsulfat har tillatt eliminering av mange virus i behandlet vann, for eksempel beta, ms2, t4 og p1, blant andre. Resultatene indikerer at behandling av vann med aluminiumsulfat gir en inaktivering av slike virus.
- Aluminiumsulfat brukes i en bar eller som støv i behandlingen av små overfladiske sår eller skrubbsår produsert ved barbering.
- Det brukes i fremstilling av aluminiumacetat, forbindelse som brukes i behandlingen av noen øreforhold. Det har også blitt brukt, uten betydelig suksess, for å lindre konsekvensene av brannmyrer biter.
- Aluminiumsulfatoppløsninger brukes, i en konsentrasjon på 5% til 10%, i den lokale behandlingen av magesår som tillater kontroll over sekresjonen deres.
- Den snerpende virkningen av aluminiumsulfat kontrakter overflatelagene i huden, koagulerende proteiner og helbredende sår.
Andre bruksområder
- Aluminiumsulfat hjelper med å kontrollere overdreven algevekst i dammer, innsjøer og vannstrømmer. Det brukes også i eliminering av bløtdyr, blant dem, den spanske sneglen.
- Gartnere bruker denne forbindelsen for å surde alkaliske jordarter. I kontakt med vannet deres, nedbryter aluminiumsulfat i aluminiumhydroksyd og fortynnet svovelsyre. Deretter utfeller aluminiumhydroksyd, gjenværende svovelsyre.
- Forsuring av jordsmonn på grunn av svovelsyre blir visualisert på en veldig kreativ måte, på grunn av eksistensen av en plante som kalles hortensia, hvis blomster blir blå i nærvær av en sur jord; det vil si at de er følsomme og reagerer på pH -endringer.
- Aluminiumsulfat griper inn i utdypingen av et skum for å bekjempe og kontrollere brannen: det reagerer med natriumbikarbonat, og produserer frigjøring av CO2. Denne gassen blokkerer tilgangen til O2 til forbrenningsstedet for materialet, og følgelig opphør av brannen som ble utviklet.
Aluminiumsulfatproduksjon
Aluminiumsulfat syntetiseres ved å reagere en forbindelse rik på aluminium, for eksempel bauxittmineral, med svovelsyre ved høye temperaturer. Følgende kjemiske ligning representerer reaksjonen:
Til2ENTEN3 + H2SW4 -> Al2(SW4)3 + 3 H2ENTEN
Aluminiumsulfat kan også dannes gjennom en nøytraliseringsreaksjon mellom aluminiumhydroksyd og svovelsyre, i henhold til følgende reaksjon:
2 til (å)3 + 3 H2SW4 + 12 timer2Eller -> til2(SW4)3.18H2ENTEN
Svovelsyre reagerer med aluminium for å danne ammoniumsulfat og frigjøring av hydrogenmolekyler i form av gass. Reaksjonen er skjematisert som følger:
2 til +3 H2SW4 -> Al2(SW4)3 + 3 H2
Typer aluminiumsulfat
Aluminiumsulfat er klassifisert i to typer: type A og type B. I type A aluminiumsulfat er faste stoffer hvite og har en jernkonsentrasjon mindre enn 0,5%.
I type B aluminiumsulfat er faste stoffer brune og har en jernkonsentrasjon mindre enn 1,5%.
Det er aluminiumsulfatproduserende næringer som har forskjellige kriterier for klassifisering. Dermed rapporterer en industri for utarbeidelse av aluminiumsulfat -type til en maksimal konsentrasjon på 0,1% jern som jernoksyd.
Mens for type B indikerer de en maksimal jernkonsentrasjon på 0,35%.
Aluminiumsulfat toksisitet
- Aluminiumsulfat er en forbindelse som utøver sin giftige handling ved kontakt med støvet, og forårsaker dermed hudirritasjon, og i tilfeller der kontakt er hyppig, dermatitt.
- I øynene forårsaker det sterk irritasjon, til og med produserer permanente skader.
- Innånding gir irritasjon av nesen og halsen, noe som kan forårsake hoste og karraspera.
- Inntaket forårsaker gastrisk irritasjon, kvalme og oppkast.
- Det er giftige effekter at selv om de ikke skyldes direkte aluminiumsulfat, er de indirekte for deres bruk. Dette er tilfelle av visse giftige effekter av aluminium, forårsaket av bruk av aluminiumsulfat i vannrensing.
- Pasienter som er kronisk dømt ved bruk av salter fremstilt i renset vann ved bruk av aluminiumsulfat, opplever veldig alvorlige helseforstyrrelser. Blant disse lidelsene nevner vi anemi, dialyse demens og en økning i beinsykdommer.
Referanser
- Wikipedia. (2018). Aluminiumsulfat. Hentet fra: i.Wikipedia.org
- Industrial Aris. Aluminiumsulfat type A og B. Hentet fra: Aris.com.PE
- Christopher Boyd. (9. juni 2014). Topp industriell bruk for aluminiumsulfat. Hentet fra: Chemservice.com
- Pubchem. (2018). Aluminiumsulfat vannfri. Hentet fra: Pubchem.NCBI.NLM.NIH.Gov
- Kjemisk andesia. (20. august 2009). Aluminiumsulfat sikkerhetsark. [PDF]. Hentet fra: Andesia.com
- Kjemisk bok. (2017). Aluminiumsulfat. Hentet fra: ChemicalBook.com

