Kobbersulfat (CUSO4) struktur, egenskaper, innhenting, bruk
- 1129
- 136
- Thomas Karlsen
Han kobbersulfat Det er en uorganisk forbindelse dannet av kobber (Cu), svovel (er) og oksygen (O) elementer (O). Den kjemiske formelen er CUSO4. Kobberen er i en oksidasjonstilstand +2, svovel +6 og oksygen har Valencia -2.
Det er et hvitt fast stoff at når det blir utsatt for miljøets fuktighet blir dets kusoblå pentahydrat4 •5H2ENTEN. Det hvite fast stoffet oppnås ved å varme opp det blå for å eliminere vannet.
 Kobbersulfat (CUO4) vannfri (uten vann i sin krystallinske struktur). W. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Kobbersulfat (CUO4) vannfri (uten vann i sin krystallinske struktur). W. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Det har blitt brukt som et antibakterielt middel i århundrer for å helbrede sår hos mennesker og dyr. Det fungerer også som et soppmiddel, som et snerpende, antidiarrheal og kontrollerende tarmsykdommer hos dyr. Det brukes også som et antihongos -middel i planter.
Imidlertid har noen av bruken av dem blitt avviklet fordi deres overskudd kan være giftig for både mennesker, dyr og planter. Konsentrasjonsintervallet der det kan brukes i er smalt og avhenger av arten.
Det brukes som en katalysator i kjemiske reaksjoner og som løsemidler tørkemiddel. Det gjør det mulig å forbedre motstanden og fleksibiliteten til noen polymerer.
Overdreven mengder av denne forbindelsen kan være skadelig for jordsmonn, da det er giftig for mikroorganismer som er gunstige for planter.
[TOC]
Struktur
Kobbersulfat dannes av et kobberion (Cu2+) og et sulfation (så42-).
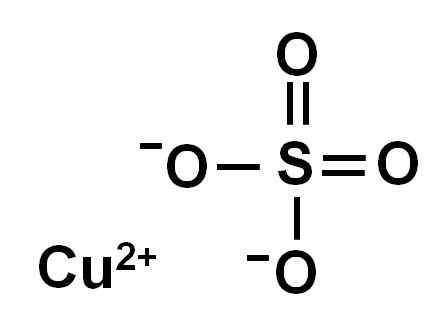 Ionica kobbersulfat (ii). Forfatter: Marilú Stea.
Ionica kobbersulfat (ii). Forfatter: Marilú Stea. På grunn av tap av to elektroner har kobberionet (II) følgende elektroniske konformasjon:
1s2 2s2 2 s6 3s2 3p6 3d9
Det kan sees at orbitalen har 3d ufullstendig (har 9 elektroner i stedet for 10).
Nomenklatur
- Vannfri kobbersulfat
- Kobbersulfat (ii)
- Kuprisk sulfat
Egenskaper
Fysisk tilstand
Grønnaktig hvitt fast eller krystallformet.
Molekylær vekt
159,61 g/mol
Smeltepunkt
Ved 560 ºC bryter det.
Tetthet
3,60 g/cm3
Løselighet
22 g/100 g vann ved 25 ° C. Uoppløselig i etanol.
Kjemiske egenskaper
Når det blir utsatt for fuktigheten i luften under 30 ° C, blir det Cuso pentahydratforbindelse4 •5H2ENTEN.
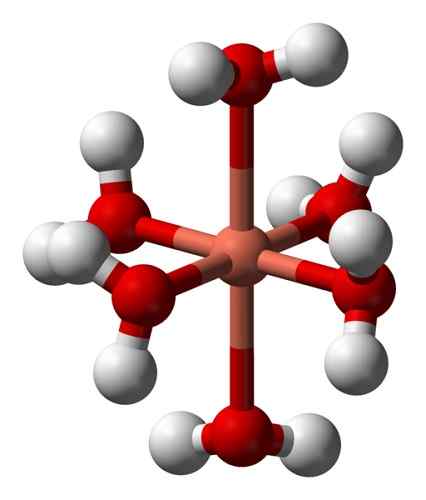
De vandige oppløsningene er blå på grunn av dannelsen av heksaacuocobre -ionet (ii) [Cu (h2ENTEN)6]2+ som produserer slik farge. I dette ionet er to av vannmolekylene lenger fra det metalliske atomet enn de fire andre.
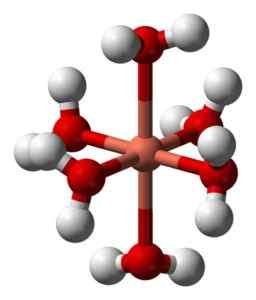 Deformert struktur av heksaacuocobre ion (ii) [Cu (h2ENTEN)6]2+. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
Deformert struktur av heksaacuocobre ion (ii) [Cu (h2ENTEN)6]2+. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. Dette skyldes den såkalte Jahn-Teller-effekten, som spår at denne typen systemer opplever forvrengningen forårsaket av det faktum at CU2+ Den har en elektronisk struktur som ender i D9, det vil si en ufullstendig orbital (det ville være komplett hvis det var D10).
Kan tjene deg: kalsiumhydroksyd (Ca (OH) 2): struktur, egenskaper, innhenting, brukHvis ammoniakk legges til (NH3) Disse løsningene dannes der NH3 Vannmolekyler fortrenger suksessivt. De er dannet for eksempel fra [Cu (NH3) (H2ENTEN)5]2+ Til [Cu (NH3)4(H2ENTEN)2]2+.
Når CUSO4 Den blir oppvarmet til nedbrytning.
Å skaffe
Vannfritt kobbersulfat kan oppnås ved total dehydrering av pentahydratforbindelsen, som oppnås ved å varme den opp til vannmolekylene fordamper.
Cuso4 •5H2O + varme → CUO4 + 5 H2Eller ↑
Pentahydratforbindelsen er blått, så Cuso -vannet oppnås når du mister krystalliseringsvannet4 Hvit vannfri.
applikasjoner
Noen av bruken overlapper hverandre med pentahydratforbindelsen. Andre er spesifikke for vannfri stoff.
Som antibakterielt middel
Det har potensiale som et antimikrobielt middel. Det har blitt brukt i tusenvis av år, selv i kulturer i Sør -Amerika og Mellom -Amerika, for å forhindre sårinfeksjon gjennom gasbind impregnert i en løsning av denne forbindelsen.
Det anslås at i mekanismen for dens antibakterielle aktivitet ionene Cu2+ De danner chelater med enzymer som er avgjørende for cellulære funksjoner til bakterier, og deaktiverer dem. De induserer også dannelsen av hydroksylradikaler OH •, som skader bakteriemembranene og deres DNA.
 Cuso4 Det kan fungere mot noen patogene bakterier. Forfatter: Gerd Altmann. Kilde: Pixabay.
Cuso4 Det kan fungere mot noen patogene bakterier. Forfatter: Gerd Altmann. Kilde: Pixabay. Nylig har det blitt rapportert at CUSO sporer4 De kan øke den antimikrobielle aktiviteten til naturlige produkter rike på polyfenoler, for eksempel granatekstrakter og infusjoner av noen typer teplanter.
I veterinærapplikasjoner
Det brukes som et antiseptisk middel og snerpende for slimhembraner og for å behandle ekstern konjunktivitt og otitis. Det tjener til å utføre terapeutiske eller profylaktiske bad for å unngå råte av storfe, sauer og andre pattedyr.
 CUO vandige oppløsninger4 De tjener til å kurere storfehull. Forfattere: Ingrid und Stefan Melichar. Kilde: Pixabay.
CUO vandige oppløsninger4 De tjener til å kurere storfehull. Forfattere: Ingrid und Stefan Melichar. Kilde: Pixabay. Det fungerer som et kaustisk middel for nekrotiske masser i ekstremiteter av storfe, stomatittsår og granulert vev av disse. Det har brukt som soppmiddel i behandlingen av fargestoff og sykdommer forårsaket av hudsopp.
Det brukes også som en Emético (agent for å provosere oppkast) hos griser, hunder og katter; som antidiarrheal snerpende for kalver og for å kontrollere tarmmoniliasis ved fjærkre og kalkun trichomoniasis.
Som et dyrefôrtilskudd
Kobbersulfat har blitt brukt som et supplement i veldig små mengder for å mate storfe, griser og fjærkre. Det tjener til å behandle kobbermangel på drøvtyggere. Når det gjelder griser og fugler brukes det som et vekststimulerende middel.
Kan tjene deg: kromatogramKobber er blitt identifisert som essensielt for biosyntesen av hemoglobin hos pattedyr, hjerte- og karstruktur, syntese av beinkollagen, enzymsystemer og reproduksjon.
Som nevnt i forrige seksjon, kan det også leveres som medisiner for sykdomskontroll. Tilskudds- og/eller medisineringsnivåer må imidlertid overvåkes med omhu.
 Korralfugler og eggene deres kan påvirkes av et overflødig kobbersulfat i kostholdet. Forfatter: Pexels. Kilde: Pixabay.
Korralfugler og eggene deres kan påvirkes av et overflødig kobbersulfat i kostholdet. Forfatter: Pexels. Kilde: Pixabay. Fra en viss mengde, som avhenger av hver art, kan en reduksjon i vekst, tap av appetitt og vekt, skade på visse organer og til og med dyrets død kan oppstå.
For eksempel, i kyllinger, reduserer tilskuddet på 0,2% eller mer inntak av maten til disse med det påfølgende vekttapet, redusert eggproduksjon og tykkelsen på skrellene deres.
I landbruksapplikasjoner
I organiske produksjonssystemer har det ikke lov til å bruke syntetiske soppdrepende midler, bare kobber- og svovelprodukter aksepteres, for eksempel kobbersulfat.
For eksempel visse sopp som angriper epleplanter, for eksempel Venturia inaequalis, elimineres med denne forbindelsen. Det antas at muligens ionene Cu2+ De er i stand til å komme inn i soppspore, denaturalisere proteiner og blokkere flere enzymer.
 Kobbersulfat tjener til å bekjempe noen sopp som angriper epler. Algirdas på LT.Wikipedia / Public Domain. Kilde: Wikimedia Commons.
Kobbersulfat tjener til å bekjempe noen sopp som angriper epler. Algirdas på LT.Wikipedia / Public Domain. Kilde: Wikimedia Commons. Viktigheten av kobber i planter
Kobberelementet er viktig i fysiologiske prosesser av planter som fotosyntese, pust og forsvar mot antioksidanter. Både mangelen på dette elementet og dets overskytende genererer reaktive oksygenerte arter som er skadelige for molekylene og strukturene til disse.
Kobberkonsentrasjonsintervallet for optimal vekst og utvikling av planter er veldig smal.
Bivirkninger på landbruket
Når dette produktet brukes overdreven i landbruksaktiviteter, kan det være fytotoksisk, forårsake for tidlig fruktutvikling og endre fargen.
I tillegg samler kobber seg på bakken og er giftig for mikroorganismer og meitemark. Dette er i konflikt med begrepet organisk jordbruk.
 Selv om CUSO4 Det brukes i organisk landbruk kan være skadelig for jordvormene. Forfatter: Patricia Maine DeGrave. Kilde: Pixabay.
Selv om CUSO4 Det brukes i organisk landbruk kan være skadelig for jordvormene. Forfatter: Patricia Maine DeGrave. Kilde: Pixabay. På kjemiske reaksjoner
Cuso4 Vannfri fungerer som en katalysator for flere reaksjoner av karbonylorganiske forbindelser med dioler eller deres epoksider, og danner dioksolaner eller acetonider. Takket være denne forbindelsen kan reaksjonene gjøres under myke forhold.
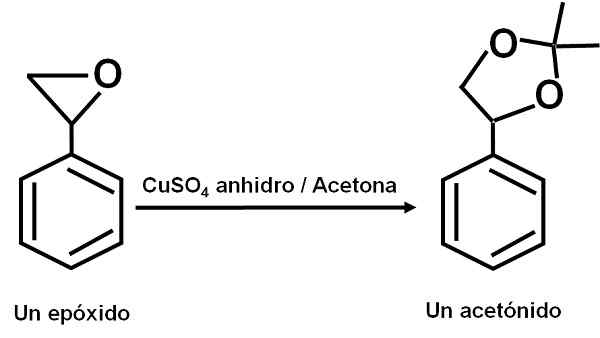 Eksempel på reaksjon der CUSO4 Vannfrie fungerer som en katalysator. Forfatter: Marilú Stea.
Eksempel på reaksjon der CUSO4 Vannfrie fungerer som en katalysator. Forfatter: Marilú Stea. Det er også rapportert at dens katalytiske virkning gjør det mulig å dehydrere sekundære, tertiære, benzyl- og aliliske alkoholer til de tilsvarende olefiner. Reaksjonen gjøres på en veldig enkel måte.
Kan tjene deg: AetolRen alkohol blir oppvarmet sammen med CUSO4 vannfri ved en temperatur på 100-160 ° C i en tid på 0,5-1,5 timer. Dermed oppstår alkohol og olefin dehydrering, rene destiller fra reaksjonsblandingen.
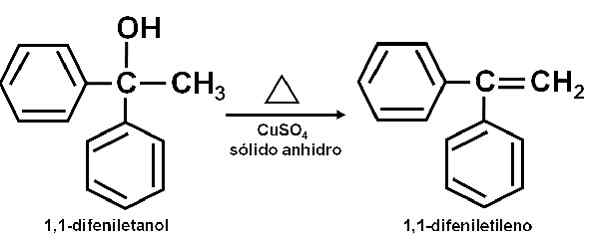 Dehydrering av en alkohol for kobbersulfat (ii) vannfri. Forfatter: Marilú Stea.
Dehydrering av en alkohol for kobbersulfat (ii) vannfri. Forfatter: Marilú Stea. Som et dehydratiserende middel
Denne forbindelsen brukes i kjemilaboratorier som tørkemiddel. Det tjener til å dehydrere organiske væsker som løsningsmidler. Absorbere vann som danner Cuo pentahydratforbindelse4 •5H2ENTEN.
 Når CUSO4 Hvit anhydro absorberer vann blir den blå pentahydratforbindelsen4.5H2ENTEN. Crystal Titan/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Når CUSO4 Hvit anhydro absorberer vann blir den blå pentahydratforbindelsen4.5H2ENTEN. Crystal Titan/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. For å forbedre polymerer
Cuso4 Anhydro har blitt brukt til å forbedre egenskapene til visse polymerer og samtidig la dem være resirkulerbare.
For eksempel er partikler av acetonforbindelsen blitt blandet med akrylonitril-butadiengummi i en spesiell mølle, og prøver å lage CUSO-partikler4 Vær veldig liten.
Kobbersulfat forbedrer polymerforeningspunktene som danner en blanding med høy motstand, hardhet og overraskende fleksibilitet.
I avviklet terapeutiske applikasjoner
Tidligere ble kobbersulfatløsninger for vasker i magen brukt når noen fikk en hvit fosforforgiftning. Imidlertid rørte løsningen omgående for å unngå kobberforgiftning.
Løsningene av denne forbindelsen ble også brukt sammen med andre stoffer for aktuelle forbrenninger i huden ved fosfor.
Noen ganger serverte de i visse former for ernæring.
Visse kremer for eksem, impetigo og intertrigo inneholdt CUO4. Løsninger ble brukt som en snerpende i øyeinfeksjoner. Noen ganger ble krystallene påført direkte på brannskader eller magesår.
Alle disse applikasjonene er ikke lenger laget på grunn av toksisiteten som kan indusere overflødig forbindelse.
Referanser
- ELLER.S. National Library of Medicine. (2019). Kobbersulfat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Montag, J. et al. (2006). En in vitro -studie på Venturia inaequalis. J. Agric. Food Chem. 2006, 54, 893-899. Lenke gjenopprettet.Springer.com.
- Holloway, a.C. et al. (2011). Forbedring av antimikrobielle aktiviteter av hele og underfraksjonert hvit te ved avhengighet av kobber (II) sulfat og vitamin C mot C mot Staphylococcus aureus; Til mekanistisk tilnærming. BMC Complement Altern Med 11, 115 (2011). Hentet fra BMCComplementMedTherapies.Biomedcentral.com.
- Sanz, a. et al. (2018). Kobberopptaksmekanisme av Talian Arabidopsis Høytkopitertransportører. Protoplasma 256, 161-170 (2019). Lenke gjenopprettet.Springer.com.
- Griminger, p. (1977). Effekt av kobbersulfat på eggproduksjon og skalltykkelse. Poultry Science 56: 359-351, 1977. Gjenopprettet fra akademiker.Oup.com.
- Hanzlik, r.P. Og Leinwetter, m. (1978). Reaksjon av epoksider og karbonylforbindelser katalysert av vannfri kobbersulfat. J. Org. Chem., Vol.43, nei.3, 1978. Gjenopprettet fra puber.ACS.org.
- Okonkwo, a.C. et al. (1979). Kobberkrav til babygriser matet renset kosthold. Journal of Nutrition, bind 109, utgave 6, juni 1979, side 939-948. Gjenopprettet fra akademiker.Oup.com.
- Hoffman, r.V. et al. (1979). Vannfri kobber (II) Sulfat: En effektivitet. J. Org. Chem., 1980, 45, 917-919. Gjenopprettet fra puber.ACS.org.
- Shao, c. et al. (2018). Forbedret strekkfasthet av akrylonitril-butadiengummi/Anhydrous kobbersulfatkompositter fremstilt ved koordinering tverrbinding. Polym. Okse. 76, 1435-1452 (2019). Lenke gjenopprettet.Springer.com.
- Betts, j.W. et al. (2018). Nye antibakterielle stoffer: Alternativer til tradisjonelle antibiotika. Kobber. I fremskritt innen mikrobiell fysiologi. Gjenopprettet fra Scientedirect.com
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Google nettsteder. Lage vannfri kobbersulfat. I paradoks hjemmekjemi. Gjenopprettet fra nettsteder.Google.com.
- « Regel T -funksjoner, slik at det tjener, eksempler
- Konstant (programmering) konsept, typer, eksempler »

