Kobbersulfat pentahydratstruktur, egenskaper, bruk

- 2398
- 472
- Anders Mathisen
Han Pentahydratkobber sulfat Det er en uorganisk forbindelse dannet av kobber (Cu), svovel (er), oksygen (O) og vann (h2ENTEN). Inneholder kobberioner (ii) (Cu2+) og sulfat (så42-). Den kjemiske formelen er CUSO4 •5H2ENTEN.
I naturen danner det Chalcantita eller Calcant Mineral, også kalt Chalclasa eller Calclasa. Det er et blått krystallinsk fast stoff.
 Kobbersulfat Cuso Kobbersulfat4 •5H2ENTEN. Forfatter: überraschungsbilder. Kilde: Wikimedia Commons.
Kobbersulfat Cuso Kobbersulfat4 •5H2ENTEN. Forfatter: überraschungsbilder. Kilde: Wikimedia Commons. Det brukes som et ernæringsmessig komplement til noen dyr som drøvtyggere, griser og fjærkre. I landbruket fungerer det som plantevernmiddel. I gruveaktiviteter tillater det å gjenopprette andre metaller.
For sin blå fargetone tjener for fargelegging av stoffer og metaller. Det har blitt brukt til å avsette metallkobber på cellulosefibre for å oppnå ledende stoffer i strøm. Det brukes også til å tilberede kobber -nanopartikler og oksider, med en rekke bruksområder.
I høye konsentrasjoner kan det være giftig for fauna og flora, så noen ganger brukes det til å eliminere skadedyr (dyr eller planter) i vannmiljøer som laguner og naturlige dammer.
[TOC]
Struktur
Denne forbindelsen dannes av kobberelementet i oksidasjonstilstanden +2 og sulfatanionen. Sistnevnte har et svovelatom med Valencia +6 omgitt av fire oksygenatomer, hver med Valencia -2. På denne måten har sulfationionen to negative ladninger.
Den har også 5 vannmolekyler i strukturen. I den følgende figuren kan du se måten de forskjellige atomene i glasset er ordnet.
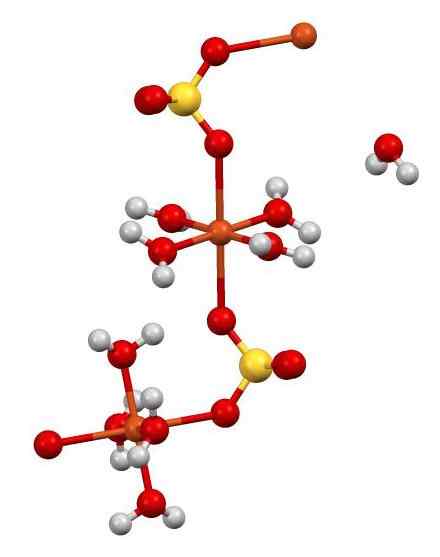 CUO -struktur4 •5H2ENTEN. Forfatter: Smokefoot. Kilde: Wikimedia Commons.
CUO -struktur4 •5H2ENTEN. Forfatter: Smokefoot. Kilde: Wikimedia Commons. Cu2+ (oransje kuler) er samtidig koordinert med 4 timers molekyler2O (oksygen = rødt; hydrogen = hvitt) og med 2 oksygenatomer i SOS42- (svovel = gul). I figur en av H -molekylene2O Det er i tilsynelatende frihet, men er en del av den krystallinske strukturen.
Nomenklatur
 Mineral fra Chalcantita Cuso4 •5H2ENTEN. Forfatter: Archaeodontosaurus. Kilde: Wikimedia Commons.
Mineral fra Chalcantita Cuso4 •5H2ENTEN. Forfatter: Archaeodontosaurus. Kilde: Wikimedia Commons. - Pentahydratkobber sulfat
- Kobberlidelse (ii) pentahydrat
- Bluejack
- Blå stein (engelsk Blå stein)
- Chalcantita, Calcantita, Chalclasa eller Calclasa
Egenskaper
Fysisk tilstand
Blå krystallinsk fast.
Molekylær vekt
249.686 g/mol
Smeltepunkt
Når det når 110 ºC, bryter det sammen.
Tetthet
2.286 g/cm3
Løselighet
Vannløselig: 22,0 g/100 g vann ved 25 ° C. Metanol løselig (velg3ÅH). Litt løselig i etanol (velg3Ch2ÅH).
Kjemiske egenskaper
Denne forbindelsen når du kommer i kontakt med vann, oppløses og danner ionene Cu2+ Og så42-. Dens løselighet i vann avtar betydelig hvis svovelsyre er til stede i vann.
Det kan tjene deg: Camp Horous alkohol: Struktur, formel, egenskaper og brukH2SW4 Gir så ioner42- Og dens tilstedeværelse genererer effekten av "vanlig ion", da dette ionet er til stede i pentahydratkobber sulfat. Oppløsning kan uttrykkes som følger:
Cuso4 •5H2Eller (fast) + vann ⇔ cu2+ + SW42- + vann
Derfor, hvis SO allerede er til stede i løsning42- av svovelsyre beveger balansen til venstre, det vil si mot dannelsen av faststoffet, og dermed avtar løseligheten.
Å skaffe
En av måtene å oppnå pentahydratkobbersulfat er å løse opp det malakittiske mineralet i vandig oppløsning av svovelsyre (H2SW4) ved kontrollert temperatur. Malquita inneholder Cu2(ÅH)2Co3 Med andre urenheter, for eksempel jern.
Den uren løsningen av kobber (II) behandles med hydrogenperoksyd (H2ENTEN2) for å sikre at jernforurensninger (ii) (tro2+) bli jern (iii) (tro3+). Sistnevnte er laget i form av jernhydroksid (tro (OH)3) ved hjelp av natriumhydroksyd (NaOH).
Utfall betyr at partikler av et uoppløselig fast stoff dannes i løsningen, som faller til bunnen av beholderen som inneholder den.
 Utseende av en konsentrert CUSO -løsning4 •5H2ENTEN. Forfatter: Public Domain fartures. Kilde: Pixabay.
Utseende av en konsentrert CUSO -løsning4 •5H2ENTEN. Forfatter: Public Domain fartures. Kilde: Pixabay. Den resulterende blandingen filtreres for å fjerne troens faste stoff (OH)3 Og den gjenværende væsken behandles med etanol (C2H5Å), metanol (velg3Å) eller svovelsyre for å utfelle alle ionene Cu2+ Cuo4 •5H2ENTEN.
Når du legger til etanol, er det mindre vann tilgjengelig for Cu -ioner2+ Og så42- er i løsning og har en tendens til å gå sammen. Fungerer som en dehydrering. Jo mer etanol det tilsettes mer solid.
Det utfelte faststoffet kan rekrystiseres for å rense det. For å gjøre dette oppløses det i vann ved en temperatur på 80-90 ° C, og deretter avkjøles løsningen ved 25-30 ° C. Pentahydratforbindelsen suser igjen og urenhetene forblir i løsning.
applikasjoner
Har et bredt intervall av kommersielle applikasjoner.
På jordbruksområdet fungerer det som plantevernmiddel, insektmiddel, ugressmiddel, soppdrepende middel, kimmord og jordtilsetningsstoff. I veterinærbehandlinger brukes det som antihelmintiske, soppdrepende og Emético (for å forårsake oppkast).
Det brukes som blått eller grønt pigment i fargestoffer og fargestoffer, som en mordant i fargen på stoffer og metaller. Også som et inntrykkstoner i fotografier og som et reagens for å intensivere negativene.
Kan tjene deg: effektiv kjernefysisk belastningDet brukes i gruveaktiviteter som et flotasjonsreagens for sink og blygjenvinning. Det tjener til å produsere andre kobberforbindelser, den brukes i brunfargen.
I mat for dyr
Denne forbindelsen brukes i kostholdet til griser i veldig små mengder som en promotør av vekst, spesielt i den bakre fasen. Mekanismen som den har denne effekten er fremdeles ukjent.
Noen forskere hevder at det reduserer populasjonen av patogene eller skadelige bakterier i tarmen av dyr og følgelig favoriserer veksten.
 Med CUSO4 •5H2O Du kan favorisere utviklingen av avvenne griser. Forfatter: Mabelamber. Kilde: Pixabay.
Med CUSO4 •5H2O Du kan favorisere utviklingen av avvenne griser. Forfatter: Mabelamber. Kilde: Pixabay. Andre lærde indikerer at det forbedrer helsen til tarmen til disse dyrene, men visse undersøkelser indikerer at intravenøs kobberinjeksjon også forbedrer veksten.
Det har også blitt brukt til samme formål i fjærkre, og har blitt brukt i kobbermangel til drøvtyggere.
I nanopartikkelsyntese
Pentahydratkobbersulfat har blitt brukt for å oppnå blandede kobber -nanopartikler og kobberoksyd (I) (Cu/Cu2ENTEN).
Nanopartikler er ekstremt små strukturer som bare kan sees gjennom et elektronisk mikroskop.
Cu/cu støv2O I form av nanopartikler har den bruker i katalyse eller akselerasjon av kjemiske reaksjoner, i halvledere og i antimikrobielle materialer, blant andre anvendelser.
I studier for skadedyrbekjempelse
Cuso4 •5H2Eller det har blitt brukt i opplevelser for å evaluere dens toksisitet mot artenes snegler Pomacea canaliculata.
Dette er innfødte bløtdyr i de tropiske regionene i Sør -Amerika som bor i forskjellige typer økosystemer, fra sumper og laguner til innsjøer og elver.
De blir studert fordi noen er vert for menneskelige parasitter som Schistosoma Mansoni (Trematode som produserer sykdommen i Bilharzia). Karacoles kan også være skadelig for landbruksavlinger i oversvømte regioner.
 Caparazones de los Caracoles Pomacea canaliculata. H. Zell/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Caparazones de los Caracoles Pomacea canaliculata. H. Zell/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.  Egg avsatt av sneglene i en vannplante. Disse sneglene utgjør noen ganger en pest som kan kontrolleres med CUSO4 •5H2ENTEN. Shan LV, National Institute of Parasitic Diseases/CC av (https: // creativecommons.Org/lisenser/av/2.5). Kilde: Wikimedia Commons.
Egg avsatt av sneglene i en vannplante. Disse sneglene utgjør noen ganger en pest som kan kontrolleres med CUSO4 •5H2ENTEN. Shan LV, National Institute of Parasitic Diseases/CC av (https: // creativecommons.Org/lisenser/av/2.5). Kilde: Wikimedia Commons. I følge studiene som er gjennomgått, er vandig pentahydratkobber sulfatløsninger ekstremt giftige for disse sneglene, så denne forbindelsen kan brukes til å eliminere bløtdyr fra infiserte områder.
Kan tjene deg: ForbrenningsreaksjonerI følge visse undersøkelser er dette fordi sneglen ikke har behov for kobberionet, så bare kontakten med dette ionet ville være tilstrekkelig for at dyret er død.
I elektrisitetsledende stoffer
Denne forbindelsen har blitt brukt til å oppnå tekstilmaterialer med integrerte elektrisitetssensorer. Denne typen stoff har applikasjon i strømlagringsenheter, trykksensorer, fotodetektor og lysutslippskjermer.
For å skaffe elektrisitetsledende stoffer er en metallfiber av vevd cellulosecellulose kalt "Lyocell" dekket med metallisk kobber. Belegget utføres på en ikke -elektrolytisk måte basert på en løsning av CUSO4 • 5H2O og andre hjelpekjemiske forbindelser.
 Lyocell -fiber. Denne typen stoff ble brukt i kobberbeleggingstester. Dobrozhinetsky/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Lyocell -fiber. Denne typen stoff ble brukt i kobberbeleggingstester. Dobrozhinetsky/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Stoffet som er oppnådd på denne måten kan overføre et elektrisk signal selv under deformasjonsbetingelser eller tøyning som opprettholder høy ledningsevne.
Effekter på miljøet
Som forklart over CUSO4 •5H2Eller når du oppløses i vann genererer kobberionet (ii).
Selv om kobber er essensielt i lave konsentrasjoner for cellulære aktiviteter av levende organismer, kan det i høye konsentrasjoner være giftig og til og med forårsake død.
Derfor utgjør tilstedeværelsen av dette ionet i miljøet en risiko for dyr og planter. I akvatiske økosystemer kan det være bioakumulert i levende vesener og i næringskjeden, og forårsake skade.
 Cuso4 •5H2O Det kan være skadelig for vannmiljøer. Forfatter: Jamesdemers. Kilde: Pixabay.
Cuso4 •5H2O Det kan være skadelig for vannmiljøer. Forfatter: Jamesdemers. Kilde: Pixabay. Faktisk har det i visse opplevelser blitt funnet at forurensningen av vannmiljøer med pentahydratkobbersulfat forårsaker at biomassen til visse vannplanter reduseres.
Noe som betyr at planter vokser mindre i nærvær av dette saltet i høye konsentrasjoner.
Referanser
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Kokes, h. et al. (2014). Oppløsning av kobber og jern fra malakittmalm og presisjon av kobbersulfat pentahydrat ved kjemisk prosess. Engineering Science and Technology, et internasjonalt tidsskrift. 2014; 17 (1): 39-44. Gjenopprettet fra Scientedirect.com.
- Azevedo B Alves., J.P. og peixoto, m.N. (2015). Biomasse reduksjon av Irriterende Salvinia Utsatt for kobbersulfat pentahydrat (CUO4.5H2ENTEN). Rev. Omgivende. Vann 2015; 10 (3): 520-529. Gjenopprettet fra Doaj.org.
- Root, w. et al. (2019). Fleksibel tekstilstrammesensor basert på kobberbelagt Lyocell-cellulosestoff. Polymers 2019, 11, 784. MDPI kom seg.com.
- Pitelli, r.TIL. et al. (2008). Akutt toksisitet av kobbersulfat og vandig ekstrakt av tørkede neemblader på snegler (Pomacea canaliculata). SCI Act. Biol. Sci. 2008; 30 (2): 179-184. Gjenopprettet fra Doaj.org.
- Badawy, s.M. et al. (2015). Syntese, karakterisering og katalytisk aktivitet av Cu/Cu2O nanopartikler fremstilt i vandig medium. Bulletin of Chemical Reaction Engineering & Catalysis. 2015; 10 (2): 169-174. Gjenopprettet fra Doaj.org.
- Justel, f.J. et al (2014). Løselighet og fysiske egenskaper til mettede oppløsninger i kobbersulfat + svovelsyre + sjøvannssystem ved forskjellige temperaturer. Brazilian Journal of Chemical Engineering. 2015; 32 (3): 629-635. Gjenopprettet fra Doaj.org.
- Park, c.S. og Kim, B.G. (2016). In vitro Løselighet av kobber (II) sulfat og dikopperklorid trihydroxide for griser. Asiatiske Austalas. J. Anim. Sci. 2016; 29 (11): 1608-1615. Gjenopprettet fra Doaj.org.
- ELLER.S. National Library of Medicine. (2019). Kobbersulfat pentahydrat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Wikipedia (2020). Chalcanthite. Innhentet fra.Wikipedia.org.
- « Marine biomasegenskaper, typer, flora, fauna
- Voks (biologisk) struktur, egenskaper, funksjon, typer »

