Kalsiumsulfid (CAS) struktur, egenskaper, innhenting, bruk
- 4217
- 843
- Mathias Aas
Han Kalsiumsulfid Det er et uorganisk fast stoff dannet av kalsium (CA) -elementet og svovelelementet (e), av kjemisk formel er CAS. Det er et gulaktig hvitt oppløselig fast stoff i vann, som finnes i naturen i noen vulkaner og i noen meteoritter i form av et mineral kalt oldhamite.
CAS når du oppløses i vann danner forskjellige forbindelser fordi svovelionene s2- blir ion sh- og OH -ioner er dannet-. Den resulterende løsningen er alkalisk. Denne forbindelsen brukes som base for selvlysende forbindelser eller som gir synlig lys under visse forhold. Disse materialene brukes også i lette malerier.
 Cas kalsiumsulfid er funnet i noen meteoritter. Forfatter: рote жравёв. Kilde: Pixabay.
Cas kalsiumsulfid er funnet i noen meteoritter. Forfatter: рote жравёв. Kilde: Pixabay. CAS har blitt ansett som mulig medisin for å behandle hjerteproblemer og blodkar som hypertensjon eller høyt trykk, som er en sykdom som påvirker en stor del av verdens befolkning.
Med kalsiumsulfid kan andre forbindelser som kalsiumnitrat og kalsiumkarbonat oppnås. Det må håndteres med forsiktighet og i kontakt med atmosfærens fuktighet kan gi h2S som er veldig giftig.
[TOC]
Struktur
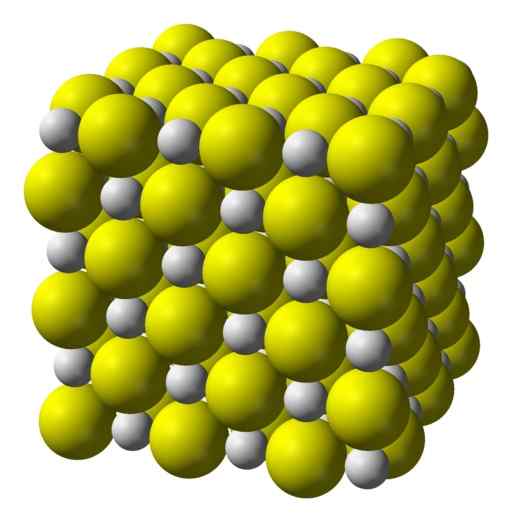
Kalsiumsulfid er en sterkt ionisk forbindelse dannet av et Ca -kalsiumion2+ og et sulfidion s2-.
Krystalliseres i en kubikkstruktur som steinsalt.
 Kubikk krystallinsk struktur av kalsiumsulfid. Gul = svovel; Hvitt = kalsium. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
Kubikk krystallinsk struktur av kalsiumsulfid. Gul = svovel; Hvitt = kalsium. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. Nomenklatur
- Kalsiumsulfid
Fysiske egenskaper
Fysisk tilstand
Gulaktig hvit krystallinsk faste, kubikkkrystaller som natriumklorid.
Molekylær vekt
72,144 g/mol
Smeltepunkt
2528 ºC
Tetthet
2,59 g/cm3
Løselighet
Løselig i vann. Uoppløselig i etanol.
Kjemiske egenskaper
Vandig løsning
Når det oppløses i vann, skilles CAS opp i kalsiumkasonene 2+ og sulfid s2-. Sistnevnte i vann tar et proton og blir Shh hydrosulfuro -ionet- Slipper et OH -hydroksylion-.
Kan tjene deg: siktetS2- + H2Eller ⇔ sh- + Åh-
Derfor er kalsiumsulfidløsninger alkalisk (de har basisk pH) og har ikke S -ioner2- Men sh-.
Bare i tilfelle at en stor mengde alkali tilsettes løsningen som NaOH -natriumhydroksyd. Balansen beveger seg mot dannelsen av svovelioner S2-.
 Kalsiumsulfid oppløses i vann som danner andre forbindelser. Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay.
Kalsiumsulfid oppløses i vann som danner andre forbindelser. Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay. SH- Du kan ta en annen proton h+ vann, dannende hydrogensulfid, som er en veldig giftig forbindelse.
Sh- + H2Eller ⇔ h2S + OH-
Derfor dannes små mengder H i vann2S og ved å bli utsatt for miljøets fuktighet, gir CAS fra seg en ubehagelig lukt som er typisk for hydrogensulfid.
Forbindelser som er til stede når de oppløses i vann
Resultatet av de tidligere indikerte vannreaksjonene er at Ca (SH) dannes2, CA (OH)2 og Ca (SH) (OH).
Cas + H2O → ca (sh) (OH)
Ca (sh) (OH) + H2O → CA (OH)2 + H2S
Syreaksjon
De samme reaksjonene som oppstår i vann får CAS til å reagere med syrer som danner H2S.
CAS + 2 HCL → CACL2 + H2S
Andre reaksjoner
Hvis en kalsiumsulfidoppløsning med svovel varmes opp, oppnås polysulfidionene42- og s32-.
Hvis CAS er oppvarmet i tørr luft eller ren oksygen, oksideres forbindelsen til kalsiumsulfittveske3 Og deretter til kalsiumsulfatveske4:
2 CAS + 3 O2 → 2 sak3
2 sak3 + ENTEN2 → 2 sak4
Med oksidasjonsmidler som Kclo kaliumklorat3, Kno kaliumnitrat3 eller blydioksid2 Voldelige reaksjoner oppstår.
Å skaffe
Kalsiumsulfid kan fremstilles ved kalsinering (oppvarming ved veldig høy temperatur) Kalsium (CA) og svovel (er) i inert atmosfære, det vil si at de ikke er til stede for eksempel oksygen eller vanndamp.
Det kan tjene deg: klorsyre (Hclo2)Ca + S + varme → CAS
Kan også oppnås ved oppvarming av kalsiumsulfatveske4 Med kull:
Sak4 + 2 C → CAS + 2 CO2
Imidlertid oppnås ikke et rent hus i sistnevnte tilfelle, da det reagerer i tillegg med saken4 danner Cao og så2.
CAS genereres også ved å brenne kullavfall.
Tilstedeværelse i naturen
CAS er naturlig til stede i Oldhamite Mineral. Dette er en del av noen meteoritter og er viktig av den vitenskapelige forskningen som utføres på solsystemet.
Det antas at Oldhamita ble dannet ved kondens i tåken som oppsto solsystemet. Det er også til stede i vulkaner.
 CAS -kalsiumsulfid er i Oldhamite Mineral, som er funnet i noen meteoritter. Leon Hupperichs/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
CAS -kalsiumsulfid er i Oldhamite Mineral, som er funnet i noen meteoritter. Leon Hupperichs/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. I tillegg produseres kalsiumsulfid naturlig ved reduksjon av saken4 (gips) Muligens ved handling av bakterier.
applikasjoner
I lette materialer
En av de mest utbredte bruken av kalsiumsulfid har vært som grunnlag for lysforbindelser. Dette er stoffer som avgir synlig lys under visse omstendigheter.
I de selvlysende forbindelsene til CAS fungerer dette som en base og aktivatorer blir lagt til strukturen som klorider av visse elementer som Cerio (CE3+) og Europio (EU2+).
Materialet som følge av CAS -unionen og aktivatoren brukes for eksempel i katodestrålerørskjermer som utgjør de gamle skjermene på datamaskiner eller datamaskiner eller gamle TV -enheter.
 Gamle datamaskinmonitorer hadde katodestrålør der noen ganger selvtillitscentforbindelser av kalsiumsulfid og aktivatorer brukes noen ganger. Forfatter: Andreas160578. Kilde: Pixabay.
Gamle datamaskinmonitorer hadde katodestrålør der noen ganger selvtillitscentforbindelser av kalsiumsulfid og aktivatorer brukes noen ganger. Forfatter: Andreas160578. Kilde: Pixabay. De brukes også i de nåværende lampene med lysemitterende dioder, eller LED (forkortelse for engelsk Lysemitterende dioder).
Kan tjene deg: Ayaroína LED -lampe. Noen kan inneholde selvlysende forbindelser av kalsiumsulfid. Ingen maskinlesbar forfatter gitt. Apper antatt (basert på krav om opphavsrett)). /CC By-SA (http: // creativecommons.Org/lisenser/by-SA/3.0/). Kilde: Wikimedia Commons.
LED -lampe. Noen kan inneholde selvlysende forbindelser av kalsiumsulfid. Ingen maskinlesbar forfatter gitt. Apper antatt (basert på krav om opphavsrett)). /CC By-SA (http: // creativecommons.Org/lisenser/by-SA/3.0/). Kilde: Wikimedia Commons. Disse materialene brukes også i lette malerier og lakk.
I medisin
Kalsiumsulfid har blitt vurdert i medisinske studier som et medikament for å behandle arteriell hypertensjon (høyt trykk i arterier). Dette er en sykdom som påvirker det kardiovaskulære systemet til mange mennesker (hjerte- og blodkar).
CAS regnes som en "giver" av h2S. Dette spiller en viktig rolle i å regulere tonen eller styrken til blodkar, slik at CAS -administrasjonen kan være et mulig middel for å behandle hypertensjon.
 Kalsiumsulfid har blitt studert som et mulig middel for det høye trykket i det kardiovaskulære systemet til syke mennesker. Forfatter: Mohamed Hassan. Kilde: Pixabay.
Kalsiumsulfid har blitt studert som et mulig middel for det høye trykket i det kardiovaskulære systemet til syke mennesker. Forfatter: Mohamed Hassan. Kilde: Pixabay. Ved å få andre forbindelser
Kalsiumsulfid gjør det mulig å fremstille andre forbindelser som kalsiumnitrat CA (nei3)2:
CAS + 2 HNO3 → CA (nei3)2 + H2S
Det har også blitt brukt for å oppnå Caco kalsiumkarbonat3. For dette blir en vandig løsning av CAS sendt til kull2:
Cas + H2Eller + co2 → H2S + Caco3
Andre apper
Kalsiumsulfid brukes også som tilsetningsstoff for smøremidler og som et flotasjonsmiddel i mineralekstraksjon.
Risiko
Kalsiumsulfid kan forårsake hud, øyne og irritasjon av luftveiene. Må manipuleres med forsiktighet og riktig sikkerhetsredskaper.
Det er en veldig giftig forbindelse for vannlevende liv, så det er farlig for disse miljøene.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Bly, d.R. (redaktør). (2005). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Ropp, r.C. (2013). Gruppe 16 (O, S, SE, Te) alkaliske jordforbindelser. Sulfid kalsium. I leksikon av de alkaliske jordforbindelsene. Gjenopprettet fra Scientedirect.com.
- Li, og.F. et al. (2009). Kalsiumsulfid (CAS), til donor av hydrogensulfid (H (2) s): En ny antihypertensiv drarug? Med Hypotes, 2009 Sep; 73 (3): 445-7. NCBI kom seg.NLM.NIH.Gov.
- Hus j.OG. og hus, k.TIL. (2016). Svovel, selen og tellurium. Forekomme i svovel. I beskrivende uorganisk kjemi (tredje utgave). Gjenopprettet fra Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Kalsiumsulfid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Øl, m. et al. (2014). Konvertering av kalsiumsulfid til kalsiumkarbonat under prosessen med utvinning av elementært svovel fra gipsavfall. Avfallsadministrasjon, 2014 nov; 34 (11): 2373-81. NCBI kom seg.NLM.NIH.Gov.
- « Kvantitative forskningsegenskaper, teknikker, eksempler
- Kalsiumsilikategenskaper, struktur, oppnå, bruker »

