Kobbersulfidstruktur, egenskaper, bruker

- 3379
- 794
- Markus Fredriksen
Han Kobbersulfid Det er en familie av uorganiske forbindelser hvis generelle kjemiske formel er CUxSog. Ja x Det er større enn og Det betyr at dette sulfidet er rikere på kobber enn i svovel; og hvis det er motsatt, x Den er mindre enn og, Da er sulfid rikere på svovel enn i kobber.
I naturen dominerer mange mineraler som representerer naturlige kilder til denne forbindelsen. Nesten alle av dem er rikere på kobber enn i svovel, og sammensetningen deres uttrykkes og forenklet av formelen medxS; her x Du kan til og med ta brøkverdier, noe som indikerer et støkiometrisk fast stoff (Cu1.75S, for eksempel).
 En prøve av Covellita -mineral, en av de mange naturlige kildene til kobbersulfid. Kilde: James St. John [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)]
En prøve av Covellita -mineral, en av de mange naturlige kildene til kobbersulfid. Kilde: James St. John [CC av 2.0 (https: // creativecommons.Org/lisenser/av/2.0)] Selv om svovel i elementær tilstand er gul, ser dens derivatforbindelser mørke farger; Slikt forekommer også med kobbersulfid. Imidlertid utviser Covelita -mineralet (overlegen bilde), som hovedsakelig er sammensatt av CUS, metallglitter og en blåaktig iridescence.
De kan tilberedes fra forskjellige kobber- og svovelkilder, ved hjelp av forskjellige teknikker og variere synteseparametere. Dermed kan du få cus nanopartikler med interessante morfologier.
[TOC]
Kobbersulfidstruktur
Lenker
Denne forbindelsen ser ut til å være krystallinsk, slik at du umiddelbart kan tenke at den er sammensatt av Cu -ioner+ (Monovalent kobber), cu2+ (Divalent kobber), S2- E, til og med, s2- og s22- (disulfur anioner), som samhandler gjennom elektrostatiske krefter eller ioniske bindinger.
Imidlertid er det en liten kovalent karakter mellom Cu og S, og derfor kan ikke CU-S-koblingen utelukkes. Fra denne resonnementet begynner den krystallinske strukturen til CU -ene (og den av alle dens avledede faste stoffer) å avvike fra de som er funnet eller karakterisert for andre ioniske eller kovalente forbindelser.
Med andre ord, det kan ikke snakkes om rene ioner, men at det midt i attraksjonene (kation-anion) er en liten overlapping av de ytre orbitalene (elektrondeling).
Koordinasjoner i Covelita
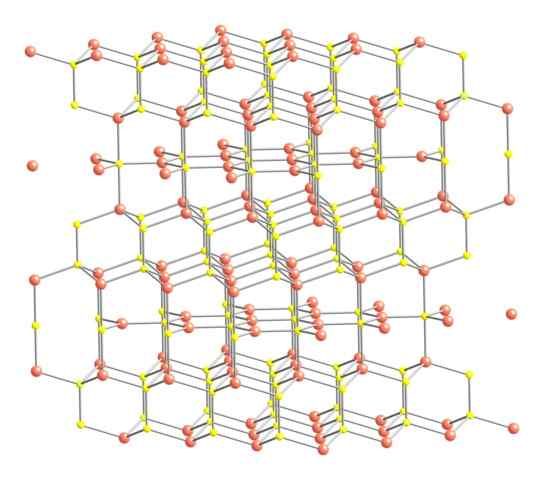 Krystallinsk struktur av Covellita. Kilde: Benjah-BMM27 [Public Domain].
Krystallinsk struktur av Covellita. Kilde: Benjah-BMM27 [Public Domain]. Når det er sagt ovenstående, vises den krystallinske strukturen til kovelitten på bildet. Den består av sekskantede krystaller (definert av parametrene til enhetscellene deres), der ionene binder og veileder i forskjellige koordinasjoner; Disse er, med et variert antall nærliggende naboer.
Kan tjene deg: type lenke på 02På bildet er kobberioner representert med rosa kuler, mens svovel med gule kuler.
Fokuser oppmerksomheten først på rosa kuler, vil det bemerkes at noen er omgitt av tre gule kuler (trigonal flat koordinering), og andre for fire (tetrahedral koordinering).
Den første typen kobber, trigonal, kan identifiseres i planene vinkelrett på de sekskantede ansiktene de gir mot leseren, der de igjen er den andre typen karbon, tetrahedral.
Delta nå på de gule kulene, har noen fem rosa kuler (trigonal bipyramid koordinering), og ytterligere tre og en gul sfære (igjen, tetrahedral koordinering); I sistnevnte er det før disulfidanionen, som kan visualiseres ned og innenfor samme struktur av kovelitten:
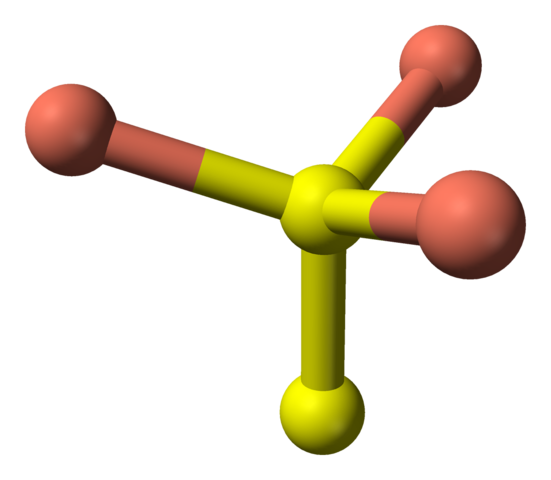 Tetrahedral koordinering av disulfidanionen i Covellita. Kilde: Benjah-BMM27 [Public Domain].
Tetrahedral koordinering av disulfidanionen i Covellita. Kilde: Benjah-BMM27 [Public Domain]. Alternativ formel
Det er da Cu -ioner2+, Cu+, S2- og s22-. Studier utført med XPS (XPS) fotoelektronikkspektroskopi påpeker imidlertid at alt kobber er som kationer Cu+; Og derfor uttrykkes den innledende CUS -formelen "bedre" som (CU+)3(S2−) (S2)-.
Legg merke til at forholdet CU: S for den forrige formelen fortsetter å være 1, og også lastene blir kansellert.
Andre krystaller
Et kobbersulfid kan ta i bruk ortorrombiske krystaller, som i polymorfen, y-Cu2S, av Calcocita; kubikk, som i en annen polymorf av kalsokitt, α-Cu2S; Tetragonal, i Anilita -mineralet, Cu1.75S; monoklinisk, i djurleita, cu1.96S, blant andre.
For hvert definert glass er det et mineral, og på sin side har hvert mineral sine egne egenskaper og egenskaper.
Egenskaper
Generell
Egenskapene til kobbersulfid er underlagt forholdet Cu: S av deres faste stoffer. For eksempel de som presenterer anioner s22- De har sekskantede strukturer, og kan være enten halvledere eller metalliske ledere.
Kan tjene deg: Kaliumfosfat (K3PO4): Struktur, egenskaper, brukHvis på den annen side er svovelinnholdet av Anions S2-, Sulfider oppfører seg som halvledere, og presenterer også ioniske konduktiviteter ved høye temperaturer. Dette er fordi ionene deres begynner å vibrere og bevege seg inne i krystallene, og transporterer dermed elektriske ladninger.
Optisk, selv om det også avhenger av kobber- og svovelsammensetningen, kan sulfider kanskje ikke absorbere stråling i det infrarøde området i det elektromagnetiske spekteret. Disse optiske og elektriske egenskapene lager potensielle materialer som skal implementeres i forskjellige enheter.
En annen variabler å vurdere, i tillegg til CU -forholdet: S, er størrelsen på krystallene. Ikke bare handler det om mer "svovel" eller "coppy" kobbersulfider, men dimensjonene til krystaller gir en unøyaktig effekt på egenskapene deres; Dermed er forskere ivrige etter å studere og se etter applikasjoner til nanopartikler CuxSog.
Covelita
Hvert mineral- eller kobbersulfid har unike egenskaper. Imidlertid er Covelita av dem alle de mest interessante fra et strukturelt og estetisk synspunkt (på grunn av dens iridescence og blå toner). Derfor er noen av dens egenskaper nevnt nedenfor.
Molmasse
95,611 g/mol.
Tetthet
4,76 g/ml.
Smeltepunkt
500 ºC; Men det går i stykker.
Vannløselighet
3.3 · 10-5 G/100 ml ved 18 ºC.
applikasjoner
Nanopartikler i medisin
Ikke bare varierer størrelsen på partiklene til rekkevidde. Dermed kan kobbersulfid danne nanosfærer, stenger, tallerkener, tynne filmer, bur, kabler eller rør.
Disse partiklene og deres attraktive morfologier tilegner seg individuelle applikasjoner i forskjellige medisinland.
For eksempel kan nanojaulas eller tomme kuler tjene som medikamenttransportører i kroppen. Nanosferaer har blitt brukt, støttet av karbonglass og karbon nanorør, for å tjene som glukosedetektorer; så vel som deres aggregater er følsomme for biomolekyler deteksjoner som DNA.
Det kan tjene deg: 6 naturlige pH -indikatorer og deres egenskaperCUS nanorør overstiger nanosferaer i glukosedeteksjon. I tillegg til disse biomolekylene, er immunosensorer designet fra tynne filmer av CUS og visse støtter for patogen deteksjon.
Nanokrystaller og amorfe aggregater av CUer kan til og med forårsake kreftcelleapoptose, uten å forårsake skade på sunne celler.
Nanovitenskap
I den fremre sub -spissen ble det sagt at nanopartiklene deres har vært en del av biosensorer og elektroder. I tillegg til slike bruksområder, har forskere og teknikere også benyttet seg av egenskapene sine for å designe solceller, kondensatorer, litiumbatterier og katalysatorer for veldig spesifikke organiske reaksjoner; uunnværlige elementer i nanovitenskap.
Det er også verdt å nevne at når de støttes på aktivert karbon, viste NPCUS-CA-settet (CA: Aktivert karbon og NP: nanopartikler) å tjene som en redusering av skadelige fargestoffer for mennesker og derfor funksjoner som en renser av Kilder fra vannkilder som absorberer uønskede molekyler.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Kobbersulfid. Hentet fra: i.Wikipedia.org
- Ivan Grozdanov og Methodija Najdoski. (nitten nitti fem). Optiske og elektriske egenskaper til kobbersulfidfilmer av variabel sammensetning. Journal of Solid State Chemistry Volume 114, utgave 2, 1. februar 1995, side 469-475. gjør jeg.org/10.1006/JSSC.nitten nitti fem.1070
- Nasjonalt senter for bioteknologiinformasjon. (2019). Kobbersulfid (CUS). PubChem -database. CID = 14831. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Peter a. Ajibade og Nandipha l. Botha. (2017). Syntese, optiske og strukturelle egenskaper
- av kobbersulfid nanokrystaller fra enkeltmolekylforløpere. Department of Chemistry, University of Fort Hare, Private Bag X1314, Alice 5700, Sør -Afrika. Nanomaterialer, 7, 32.
- Samarbeid: Forfattere og redaktører av bind III/17E-17F-41C (S.F.). Kobbersulfider (Cu2s, Cu (2-X) S) krystallstruktur, latice-parametere. I: Madelung eller., Rössler u., Schulz m. (Eds) Ikke-tetrahedralt bundne elementer og binære forbindelser I. Landolt-Börnstein-Group III Condensed Matter (numeriske data og funksjonelle forhold i vitenskap og teknologi), vol 41c. Springer, Berlin, Heidelberg.
- Momtan, f., Vafaei, a., Ghaedi, m. et al. Koreansk J. Chem. Eng. (2018). Påføring av kobbersulfid nanopartikler lastet aktivert karbon for samtidig adsorpsjon av termarfargestoffer: Responsoverflatemetodikk. 35: 1108. gjør jeg.org/10.1007/S11814-018-0012-1
- Goel, s., Chen, f., & Cai, w. (2014). Syntese og biomedisinske anvendelser av kobbersulfid -nanopartikler: Fra sensorer til theranostics. Liten (Weinheim an Der Bergstrasse, Tyskland), 10 (4), 631-645. Doi: 10.1002/smll.201301174

