Sinksulfid (Zns)
- 3436
- 327
- Marius Aasen
 Sinksulfid. Kilde: Wikimedia Commons
Sinksulfid. Kilde: Wikimedia Commons Hva er sinksulfid?
Han Sinksulfid Det er en uorganisk forbindelse av formel znS, dannet av Zn -kationer2+ og anioner s2-. Det finnes i naturen hovedsakelig som to mineraler: Wurtzite og Spheny (eller sinkblenda), sistnevnte er dens viktigste form.
Sphenhell er presentert i svart natur på grunn av urenheter den presenterer. Presenterer rent hvite krystaller, mens Wurtzita har gråaktige hvite krystaller.
Sinksulfid er uoppløselig i vann. Det kan forårsake miljøskader, siden det trenger inn i bakken og forurenser grunnvann og deres strømmer.
Sinksulfid kan forekomme, blant andre reaksjoner, korrosjon og nøytralisering.
Av korrosjon:
Zn +H2S => Zns +H2
Av nøytralisering:
H2S +Zn (OH)2 => Zns +2H2ENTEN
Sinksulfid er et fosforescerende salt, som gir det kapasitet til flere bruksområder og applikasjoner. I tillegg er det en halvleder og en fotokatiserende.
Sinksulfidstruktur
Sinksulfid vedtar krystallinske strukturer styrt av elektrostatiske attraksjoner mellom Zn -kationen2+ og anion s2-. Disse er to: Spheny eller sinkblenda, og Wurzita. I begge ioner minimerer frastøtninger mellom like ioner.
Sinkblenda er den mest stabile i terrestriske forhold med trykk og temperatur; Og Wurzita, som er mindre tett, er resultatet av den krystallinske omorganiseringen på grunn av temperaturøkningen.
De to strukturene kan sameksistere i det samme Zns -faststoffet samtidig, selv om Wurzita, veldig sakte, vil ende opp.
Sinkblenda
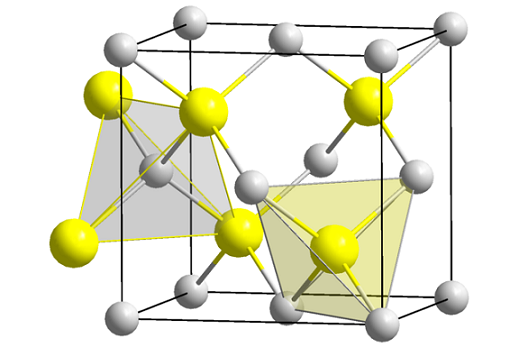
 Sinkblendingstruktur (Spheny). Kilde: Wikimedia Commons
Sinkblendingstruktur (Spheny). Kilde: Wikimedia Commons Det overlegne bildet viser den kubiske cellen sentrert på ansiktene til sinkblendingstrukturen. De gule kulene tilsvarer S -anionene2-, og grå til Zn -kationer2+, Ligger i hjørnene og i sentrene til kubenes ansikt.
Kan tjene deg: Isobutil: Nomenklatur, trening, struktur og egenskaperLegg merke til tetraedriske geometrier rundt ionene. Sinkblenda kan også være representert av disse tetrahedraene, hvis hull inne i glasset har samme geometri (tetrahedrale huler).
Dessuten blir ZnS -andelen oppfylt i enhetscellene; det vil si en proporsjon 1: 1. Dermed for hver Zn -kation2+ Det er en anion s2-. På bildet kan det se ut som grå kuler florerer, men i virkeligheten når de er i hjørnene og sentrum av navet, blir de delt av andre celler.
For eksempel, hvis de fire gule kulene som er inne i boksen er tatt, bør "stykkene" på alle de grå kulene rundt legge til det samme (og gjøre det), fire. Dermed er det i den kubiske enhetlige cellen fire Zn2+ og fire s2-, Zns støkiometriske andel er oppfylt.
På samme måte er det viktig å understreke at det er tetrahedrale hull fremover og bak de gule kulene (plassen som skiller dem fra hverandre).
Wurzita
 Wurzite -struktur. Kilde: Wikimedia Commons
Wurzite -struktur. Kilde: Wikimedia Commons I motsetning til strukturen til sinkblendaen, vedtar Wurzita et sekskantet krystallinsk system (overlegen bilde). Dette er mindre kompakt, så det faste stoffet har mindre tetthet.
Ionene i Wurzita har også tetrahedrale miljøer og en 1: 1 -andel som stemmer overens med ZNS -formelen.
Sinksulfidegenskaper
Farge
Det kan presenteres på tre måter:
-Wurtzita, av hvite og sekskantede krystaller.
-Sphenhell, av hvite-rike krystaller og kubikkkrystaller.
-Som et hvitt til gråaktig eller gulaktig hvitt pulver, og kubikk gulaktige krystaller.
Smeltepunkt
1.700 ° C.
Vannløselighet
Praktisk talt uoppløselig (0,00069 g/100 ml ved 18 ° C).
Løselighet
Uoppløselig i alkalier, oppløselig i fortynnede mineralsyrer.
Tetthet
Kuler 4.04 g/cm3 og Wurtzita 4.09 g/cm3.
Hardhet
Det har en hardhet på 3 til 4 på MOHS -skalaen.
Stabilitet
Når du inneholder vann oksiderer sakte sulfat. I et tørt miljø er det stabilt.
Nedbrytning
Når han er oppvarmet ved høye temperaturer, avgir han giftige sink og svovelhoveddamp.
Det kan tjene deg: natriumhydrid (NAH): egenskaper, reaktivitet, farer, brukSinksulfid -nomenklatur
Den elektroniske konfigurasjonen av Zn er [AR] 3D104s2. Når du mister de to elektronene i 4S -orbitalen, er det som Zn -kationen2+ Med sine orbitaler av fulle. Derfor, siden elektronisk Zn2+ Det er mye mer stabilt enn Zn+, Den har bare en valens på +2.
Derfor er det utelatt for bestandsnomenklaturen, og legger til sin valens innelukket i parenteser og med romertall: sinksulfid (II).
Systematiske og tradisjonelle nomenklinger
Men det er andre måter å ringe Zns i tillegg til den som allerede er hevet. I det systematiske er antallet atomer i hvert element spesifisert med de greske tellerne, med det eneste unntaket av elementet til høyre når det bare er en. Dermed blir Zns kåret til: bollesinksulfid (og ikke monozinc monosulfuro).
Når det gjelder den tradisjonelle nomenklaturen, til sink når du har en enkelt valens på +2, legges den til ved å legge til suffikset -CO. Følgelig er det tradisjonelle navnet: zínc sulfidICO.
Sinksulfidbruk
Som pigmenter eller belegg
Sachtolith
Sachtholith er et hvitt pigment laget med sinksulfid. Det brukes i kutter, mastiques, fugemasse, lavere deksler, latexmaling og skilting.
Bruken kombinert med absorberende pigmenter av ultrafiolett lys, for eksempel mikrotitan eller gjennomsiktige jernoksydpigmenter, er nødvendig i værresistente pigmenter.
Zns og latexmalerier
Når Zns brukes i latex eller strukturerte malerier, har den forlenget mikrobicidhandling.
Vinduer og flyrammer
På grunn av sin store hardhet og motstand mot brudd, erosjon, regn eller støv, gjør det det egnet for utvendige infrarøde vinduer eller i flyrammen.
Belegg og annen bruk
ZN -ene brukes i belegg av rotorer som brukes i transport av forbindelser, for å redusere slitasje. I tillegg brukes det i produksjon av utskriftsblekk, isolerende forbindelser, termoplastisk pigmentering, plastbestandig mot elektroluminescerende flammer og lamper.
Kan tjene deg: Tunsen lettere: Kjennetegn, funksjoner, eksempler på brukNattvisjonsenheter og skjermer
-Sinksulfid kan være gjennomsiktig, og kunne brukes som et vindu for synlig optikk og infrarød optikk. Det brukes i nattsynsenheter, på TV -skjermer, radarskjermer og lysstoffrør.
Elektroluminescens
ZNS -doping med Cu brukes i produksjonen av elektroluminescenspaneler. I tillegg brukes det i rakettframdrift og gravimetri.
For sin fosforescens
Fosforescensen brukes til å farge klokke nåler og dermed visualisere tiden i mørket; Også i malerier for leker, nødsignaler og trafikkvarsler.
Fosforescens gjør at bruk av sinksulfid i katodestrålrør og på røntgenskjermer kan skinne i mørke punkter. Fargen på fosforescens avhenger av aktivatoren som brukes.
Halvleder, fotokatisering og katalysator
- Spheny og Wurtzite er bredbåndssemisk halvledere. Sphaleritten har en 3,54 EV -båndspalte, mens Wurtzita har en 3,91 EV -båndbit.
- ZnS brukes i fremstilling av en fotokatalysator sammensatt av CD -er - ZnS/zirkonium - titanfosfat, brukt til hydrogenproduksjon under synlig lys.
- Griper inn som en katalysator for nedbrytning av organiske miljøgifter. Det brukes til å forberede en fargesynkronisator i LED -lamper.
- Nanokrystallene brukes til ultrasensibel proteindeteksjon. For eksempel ved å utstede kvantepoeng med Zns. Det brukes i fremstilling av en kombinert fotokatalysator (CDS/Zns) -TIO2 for elektrisk produksjon via fotoelektrokatalyse.
Referanser
- Pubchem (2018). Sinksulfid. Hentet fra: Pubchem.NCBI.NLM.NIH.Gov
- Quiminet (16. januar 2015). Hvitt pigment basert på sinksulfid. Gjenopprettet fra: Quiminet.com
- Wikipedia (2018). Sinksulfid. Hentet fra: i.Wikipedia.org
- II-VI UK (2015). Sinksulfid (Zns). Hentet fra: II-VI.er
- Rob Toreki (30. mars 2015). Zincblende (ZNS) -strukturen. Hentet fra: ilpi.com
- Chemistry Librettexts (22. januar 2017). Structure-Zinc Blile (ZNS). Hentet fra: Chem.Librettexts.org
- Reade (2018). Sulfidsulfid/ sink (ZNS). Hentet fra: Reade.com

