Levere forskjellige egenskaper, struktur, funksjoner
- 3731
- 266
- Theodor Anders Hopland
De Dysmutas superoksyd (Sod) enten oksidalt superoksyd, De utgjør en familie av allestedsnærværende enzymer i naturen, hvis hovedfunksjon består i forsvaret av aerobe organismer mot oksygenfrie radikaler, spesielt superoksydanioniske radikaler.
Reaksjonen som disse enzymene katalyserer forekommer praktisk talt i alle celler som er i stand til å puste (aerobic) og er essensiell for deres overlevelse, siden den eliminerer radikal toksisk fri for oksygen, både i eukaryoter og prokaryoter.
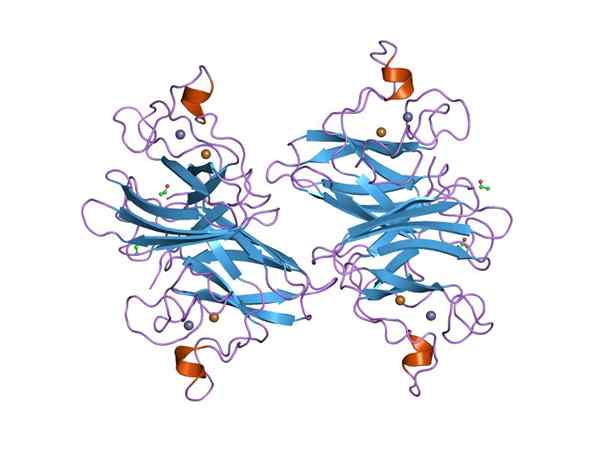
 Grafisk representasjon av en Dymputase Superoxide (SOD) CU-ZN (Kilde: Jawahar Swaminathan og MSD-ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons)
Grafisk representasjon av en Dymputase Superoxide (SOD) CU-ZN (Kilde: Jawahar Swaminathan og MSD-ansatte ved European Bioinformatics Institute [Public Domain] via Wikimedia Commons) via Wikimedia Commons) Mange sykdommer hos dyr er relatert til akkumulering av forskjellige reaktive oksygenarter, og det samme gjelder for planter, gitt at miljøet pålegger mange og konstante typer oksidativt stress som blir overvunnet takket være aktiviteten til å forstyrre superoksyd.
Denne gruppen av enzymer ble oppdaget i 1969 av McCord og Fridovich, og siden har det blitt gjort betydelige fremskritt angående disse enzymene og reaksjonene som katalyserer hos levende vesener.
[TOC]
Kjennetegn
Dysmutas superoksyd reagerer med superxide -radikaler til virkelig høye hastigheter, noe som betyr en veldig effektiv forsvarslinje for fjerning av disse molekylene.
Hos pattedyr er minst tre isoformer blitt beskrevet for henholdsvis overroksyddysmutase kjent som SOD1, SOD2 og SOD3.
To av disse isoformene har kobber- og sinkatomer i sine katalytiske sentre og skiller seg fra hverandre når det.
SOD2- eller Mn-SOD-isoformen, i motsetning til de to foregående, har et manganatom som en kofaktor og beliggenheten virker begrenset til mitokondriene i de aerobe celler.
SOD1 -isoenzymer er hovedsakelig i cytosol, selv om de også er blitt påvist i kjernefysiske rom og lysosomer. SOD 3 isoenzymer, tvert imot, er blitt beskrevet i blodplasmaet til mennesker, i lymfe og hjernevæsker.
Kan tjene deg: hvordan endres levende vesener over tid?Hver av disse isoformene er kodet av forskjellige gener, men tilhørende samme familie og dens transkripsjonelle regulering styres i hovedsak av ekstra-intracellulære forhold, som utløser forskjellige interne signalfotsfall.
Annet dismint superoksyd
Dysmonisk superoksyd med katalytiske steder som har kobber- og sink- eller manganioner er ikke unike for pattedyr, disse er også til stede i andre organismer som inkluderer planter og bakterier i forskjellige klasser.
Det er en ekstra gruppe dysmutas superoksyd, som ikke finnes hos pattedyr, og som er lett gjenkjennelig, siden de på sitt aktive sted har jern i stedet for noen av de tre ionene som tidligere er beskrevet for de andre klassene dysmatøs superoksyd.
I OG. coli, Overroksyddysmi -i at den inneholder jern er et perplastisk enzym også ansvarlig for deteksjon og eliminering av oksygenfrie radikaler generert under pust. Dette enzymet ligner det som finnes i mitokondriene til mange eukaryoter.
Plantene har de tre typene enzymer: de som inneholder kobber og sink (Cu/Zn-SOD), som inneholder mangan (MN-SOD) og de som inneholder jern (Fe-SOD) i sitt aktive senter og i disse organismer de trener analoge funksjoner med de av ikke-vegetale enzymer.
Reaksjon
Dysmy-Superoxide-enzymsubstrater er superoksydanioner, som er representert som O2- og som er mellomliggende forbindelser i oksygenreduksjonsprosessen.
Reaksjonen de katalyserer kan betraktes i generelle linjer som transformasjonen (disputasjon) av frie radikaler for dannelse av molekylært oksygen og hydrogenperoksyd, som frigjøres til miljøet eller ansatte som et underlag fra andre enzymer, henholdsvis.
Kan tjene deg: glukaner: struktur, egenskaper og funksjonerHydrogenperoksyd kan deretter elimineres fra celler takket være virkningen av noen av de men peroksidase- og katalase -glutation -enzymer, som også utøver viktige funksjoner i cellebeskyttelse.
Struktur
Dysmutas superoksyd -isoenzymer hos mennesker kan avvike fra hverandre når det gjelder visse strukturelle aspekter. For eksempel er SOD1 -isoenzym.
Den andre gruppen av dysmatøs superoksyd, Fe-sod som er til stede i planter og andre organismer enn pattedyr, er Dimérrica-enzymer av identiske underenheter, det vil si at de er homodimerer.
I noen planter inneholder disse Fe-SOD en antatt N-terminal signalsekvens for transport i det indre av kloroplaster, og andre inneholder en triqutransport C-terminal sekvens til peroksisomer, så det antas at dens subcellulære distribusjon er begrenset av rommene.
Molekylstrukturen til de tre typene av overekssidenzymer blir konsultert, i hovedsak, av alfa-propeller og B-på-angitte ark.
Funksjoner
Dysmonisk superoksyd forsvarer celler, organer og kroppsvev av skader som oksygenfrie radikaler kan forårsake hvordan lipidperoksydasjon, protein -denaturering og mutagenese av DNA.
Hos dyr kan disse reaktive artene også forårsake hjertelesjoner, akselerere aldring og delta i utviklingen av inflammatoriske sykdommer.
Planter krever også den essensielle enzymatiske aktiviteten av overoksiddysmutase, siden mange stressende forhold i miljøet øker oksidativt stress, det vil si konsentrasjonen av deaktive reaktive arter.
Hos mennesker og andre pattedyr har de tre isoformene beskrevet for overroksyddysmutase forskjellige funksjoner. SOD2 -isoenzym deltar for eksempel i celledifferensiering og tumorogenese og også i beskyttelse mot hyperoksi indusert lungetoksisitet (høy oksygenkonsentrasjon).
Kan tjene deg: inulin: struktur, egenskaper, mat, kontraindikasjonerFor noen arter av patogene bakterier fungerer SOD -enzymer som "virulensfaktorer" som lar dem overvinne mange oksidative stressbarrierer som de kan møte under invasjonsprosessen.
Relaterte sykdommer
En reduksjon i superoksyddysmutaseaktivitet kan gis av flere faktorer, både interne og eksterne. Noen er relatert til direkte genetiske defekter i kodingsgener for SOD -enzymer, mens andre kan være indirekte, relatert til uttrykk for regulatoriske molekyler.
Stort antall patologiske forhold til mennesker er relatert til SOD -enzymer, inkludert overvekt, diabetes, kreft og annet.
Når det gjelder kreft, har det blitt bestemt at det er et stort antall typer kreftsvulster som har lave nivåer av noen av de tre superoksydene til pattedyr (SOD1, SOD2 og SOD3).
Oksidativt stress som superoksyd dismutaseaktivitet forhindrer, er også assosiert med andre leddpatologier som slitasjegikt, revmatoid artritt. Mange av disse sykdommene har å gjøre med uttrykk for faktorer som hemmer SOD-aktivitet, for eksempel TNF-a-faktor.
Referanser
- Fridovich, i. (1973). Swiden Dysmuta. Annu. Rev. Biochem., 44, 147-159.
- Johnson, f., & Giulivi, c. (2005). Superoksyddysmutter og IM påvirker menneskers helse. Aspekter av medisinmolekylær, 26, 340-352.
- Oberley, l. W., & Bueftner, G. R. (1979). Rollen til Superoxide Distine i kreft: En gjennomgang. Kreftforskning, 39, 1141-1149.
- Taylor, p., Bowler, c., Camp, w. Van, Montagu, M. Van, Inzé, D., & Stekt, k. (2012). Superoksyd stygg i planter. Kritiske anmeldelser i plantevitenskap, 1. 3(3), 37-41.
- Zelko, i., Mariani, t., & Folz, r. (2002). Superoxide Distam Multigene-familie: I sammenligning av Cuzn-SOD (SOD1), Mn-SOD (SOD2) og EC-SOD (SOD3) genstrukturer, evolusjon og uttrykk. Free Radical Biology & Medicine, 33(3), 337-349.
- « Oligosakkarider Kjennetegn, sammensetning, funksjoner, typer
- José Rubén Romero -biografi, stil, fungerer »

