Aromatiske nukleofile substitusjonseffekter, eksempler
- 2544
- 799
- Prof. Theodor Gran
De Aromatisk nukleofil substitusjon (SNAR) er en reaksjon som oppstår i organisk kjemi, som består i forskyvningen av en god utgående gruppe av en innkommende nukleofil. Fra dets syn på mekanismen og elektroniske aspekter er det det motsatte ansiktet til den aromatiske elektrofile substitusjonen (Sear).
Generelt er den utgående gruppen et halogen, som kommer ut som Haluro x anion-. Denne reaksjonen kan bare skje hvis den aromatiske ringen (for det meste benzen) er mangelfull i elektroner; det vil si hvis du har elektrontrekkersubstituente grupper.
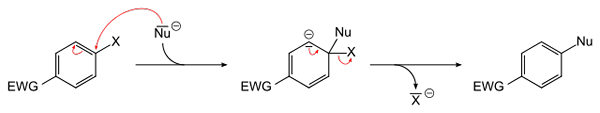
 Generell ligning for en aromatisk nukleofil substitusjon. Kilde: Sponk [Public Domain]
Generell ligning for en aromatisk nukleofil substitusjon. Kilde: Sponk [Public Domain] Det overordnede bildet skjemaer det som ble sagt i forrige avsnitt. EWG Electron Attractor Group (for sin forkortelse på engelsk: Elektronuttrekkingsgruppe), aktiverer den aromatiske ringen for det nukleofile angrepet av den negative Nu -arten-. Det kan sees at en mellomledd er dannet (i sentrum), hvor Haluro X slippes ut eller utgitt-.
Legg merke til at det på enkle x termer erstattes av NU i en aromatisk ring. Denne reaksjonen er veldig allsidig og nødvendig i syntesen av nye medisiner, så vel som i studier av syntetisk organisk kjemi.
[TOC]
Generelle funksjoner
Den aromatiske ringen kan "lades" eller "last ned" fra elektroner avhengig av hva deres substituenter er (de som erstatter den originale C-H-koblingen).
Når disse substituentene kan donere elektronisk tetthet til ringen, sies det at de beriker den fra elektroner; Hvis de tvert imot er attraktører av elektronisk tetthet (EWG nevnt ovenfor), sies det da at de utgjør elektronringen.
I alle fall aktiveres ringen for en spesifikk aromatisk reaksjon, mens den er deaktivert for den andre.
For eksempel sies en aromatisk ring rik på elektroner å være aktiv for aromatisk elektrofil substitusjon; Det vil si at du kan donere elektronene dine til en elektrofilatart, og+. Imidlertid vil det ikke donere elektroner til en Nu -art-, Siden negative ladninger ville frastøte hverandre.
Kan tjene deg: molekylær orbital teoriNå, hvis ringen er dårlig i elektroner, har den ikke hvordan de skal gi dem til arten og+ (Sear forekommer ikke); I stedet er det tilgjengeligheten å akseptere elektronene til NU -arten- (SNAR utvikler seg).
Forskjeller med aromatisk elektrofil substitusjon
Avklarte de generelle aspektene ved innreise, noen forskjeller mellom SNAR og Sear kan nå vises:
- Den aromatiske ringen fungerer som en elektrofil (dårlige elektroner) og blir angrepet av en nukleofil.
- En utgående gruppe X erstattes fra ringen; Ikke en h+
- Ingen karbokasjoner dannes, men formidlere med en negativ ladning som kan flyttes ved resonans
- Tilstedeværelsen av mer attraktive grupper i ringen akselererer substitusjonen i stedet for å bremse den
- Endelig utøver disse gruppene ikke direktører på hvor (hvor karbon) erstatningen vil oppstå. Erstatningen vil alltid forekomme i karbon knyttet til den avtroppende gruppen X.
Det siste punktet er også illustrert på bildet: C-X-lenken er ødelagt for å danne den nye C-NU-lenken.
Effekter
Av antall substituenter
Naturligvis er de dårligere i elektroner ringen, jo raskere vil snaren og det minst drastiske være forholdene som kreves for at den skal oppstå. Tenk på følgende eksempel representert i det nedre bildet:
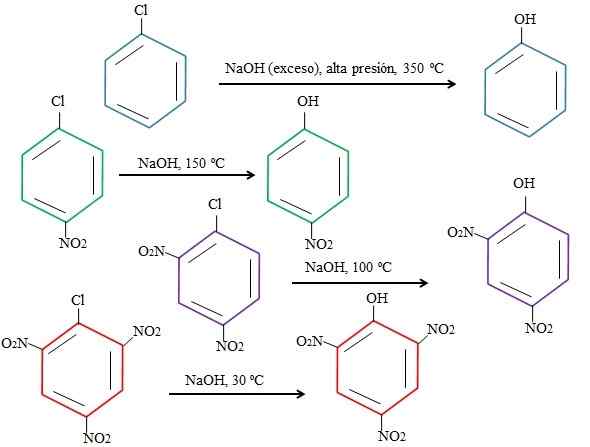 Effekter av substituenter på erstatningene av 4-nitroclorobenzen. Kilde: Gabriel Bolívar.
Effekter av substituenter på erstatningene av 4-nitroclorobenzen. Kilde: Gabriel Bolívar. Merk at 4-nitroclorobenzen (blå ring) krever drastiske forhold (høyt trykk og en temperatur på 350 ºC) til utskifting av CL med. I dette tilfellet er klor den avtroppende gruppen (CL-), og nukleofile hydroksyd (OH-).
Det kan tjene deg: 4 perioder med kjemi: Fra forhistorie til i dagNår gruppen ikke vises2, som er en elektrontrekker (grønn ring), kan substitusjonen utføres ved en temperatur på 150 ºC ved omgivelsestrykk. Ettersom antallet grupper øker nei2 Til stede (lilla og røde ringer), foregår erstatning ved stadig lavere temperaturer (henholdsvis 100 ºC og 30 ºC).
Derfor gjør ikke grupper2 De akselererer snaren og unlift fra elektroner til ringen, noe som gjør den mer utsatt for angrepet av OH-.
De relative stillingene til CL vil ikke bli forklart her med hensyn til ikke2 i 4-nitroklorbenzen, og hvordan de endrer hastigheten på reaksjonen; For eksempel er reaksjonshastighetene til 2-nitroklorbenzen og 3-nitrochlorobenzen forskjellige, og sistnevnte er de tregeste sammenlignet med de andre isomerer.
Av den utgående gruppen
Tilbake til 4-nitroclorbenzen, er substitusjonsreaksjonen tregere hvis du sammenligner den for din fluorerte motpart:
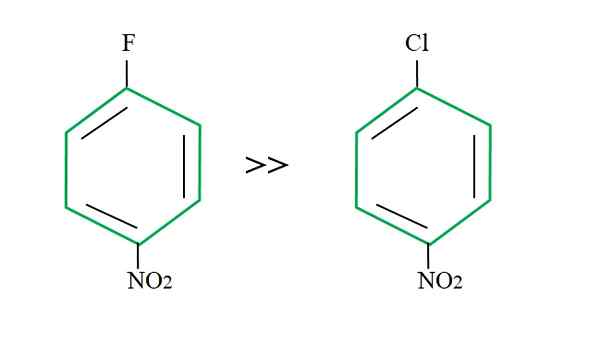 Utgående gruppeeffekt på SNAR -reaksjoner. Kilde: Gabriel Bolívar.
Utgående gruppeeffekt på SNAR -reaksjoner. Kilde: Gabriel Bolívar. Forklaringen på dette kan ikke ligge i en annen variabel at forskjellen mellom F og CL. Fluor er en elendig utgående gruppe, fordi C-F-lenken er vanskeligere å bryte enn C-Cl-lenken. Derfor er ikke sammenbruddet av denne lenken det avgjørende trinnet for hastigheten for SNAR, men tilsetningen av NU- til den aromatiske ringen.
Fluoren for å være mer elektronegativ enn klor, karbonatom knyttet til det har større elektronisk mangel (CΔ+-FΔ-). Følgelig er karbonet i C-F-koblingen mye mer sannsynlig å bli angrepet av NU- enn C-CL-lenken. Det er grunnen til at erstatningen av f av OH er mye raskere enn CL av OH.
Kan tjene deg: Kobbersulfid: Struktur, egenskaper, bruksområderEksempel
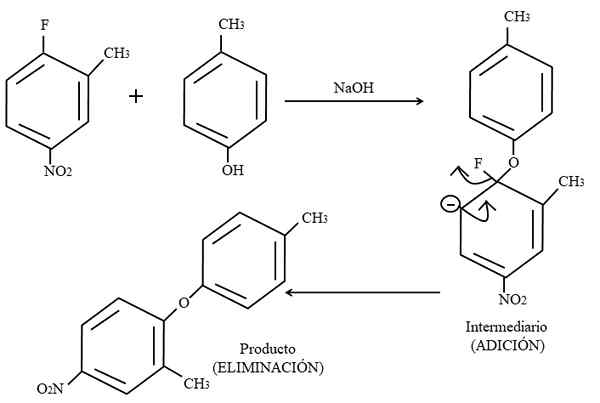 Aromatisk elektrofilskift. Kilde: Gabriel Bolívar.
Aromatisk elektrofilskift. Kilde: Gabriel Bolívar. Til slutt vises et eksempel på denne typen organiske reaksjoner i det høyere bildet nedenfor. Para-Coresol gir ikke utseendet som en nukleofil; Men med et grunnleggende medium er OH-gruppen ubeskyttet, og etterlater en fenoksydanion, som angriper 2-metyl-4-nitrofluorzen.
Når dette angrepet skjer, sies det at nukleofilen tilsettes elektrofilen. Dette trinnet kan sees til høyre for bildet, der mellomliggende forbindelse med begge substituenter som tilhører ringen dannes.
Ved å legge til para-coresol, vises det en negativ belastning som flytter resonans inne i ringen (legg merke til at det slutter å være aromatisk).
På bildet vises den siste resonansstrukturen knapt, som fluor er ferdig som f-; Men i virkeligheten blir denne negative belastningen disoccupy selv i gruppens oksygenatomer2. Etter tilsetning av eliminasjonen, den siste, som er når produktet endelig dannes.
Endelig kommentar
Gruppen nr2 gjenværende kan reduseres til NH -gruppen2, Og derfra er det mulig å gjøre mer synteseaksjoner for å endre det endelige molekylet. Dette viser det syntetiske potensialet til SNAR, og at dens mekanisme i tillegg består av to trinn: en av tillegg og eliminering en av.
For øyeblikket er det imidlertid eksperimentelle og beregningsmessige bevis på at reaksjonen i virkeligheten fortsetter etter en samlet mekanisme, der begge trinnene oppstår samtidig gjennom et aktivert kompleks og ikke en mellomledd.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Wikipedia. (2019). Nukleofil aromatisk substitusjon. Hentet fra: i.Wikipedia.org
- James Ashenhurst. (6. september 2019). Nukleofil aromatisk substitusjon (NAS). Gjenopprettet fra: MasterorganicChemistry.com
- Kjemi librettexts. (5. juni 2019). Nukleofil aromatisk substitusjon. Gjenopprettet fra: Chem.Librettexts.org

