Kollisjonsteori -systemer, energi, eksempler
- 4252
- 650
- Jonathan Carlsen
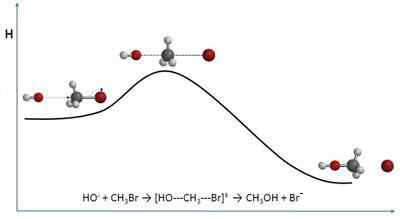
De kollisjonsteori Forklar hastighetene på kjemiske reaksjoner fra et bare molekylært perspektiv. Det er derfor nært kjemisk kinetikk. I stedet for å nærme seg hastigheter når det gjelder konsentrasjoner, gjør det det basert på kollisjonsfrekvenser.
Når du snakker om kollisjoner, kan bildet av noen biljardkuler komme til tankene som påvirker hverandre på bordet. Selv om denne teorien antar at den er sfæriske, oppfører ikke denne teorien at dens former er sfæriske, på samme måte. Molekylære kollisjoner er forskjellige på flere måter, både romlig og energi.

Denne teorien, selv om den kan være matematisk litt kompleks og vise betydelige variasjoner angående eksperimentelle resultater, tilbyr et bilde av synlige tolkninger og uten abstrakte aspekter.
Selv om det brukes til gassformede systemer eller veldig utvannede løsninger, kan prinsippene omfatte enhver reaksjon og fysisk medium.
[TOC]
Betingelser for at reaksjoner oppstår
I følge kollisjonsteori er det tre betingelser for reaksjoner som skal oppstå:
- Kjemiske arter (ioner, molekyler, radikaler, etc.) De må kollidere effektivt.
- De må bære nok energi til sammenbruddet av koblingene sine.
- I tillegg må påvirkningsorientering være veldig spesifikk.
Molekylære kollisjoner
 Som i bowling foregår reaksjoner bare når effektive kollisjoner oppstår når det gjelder energi og veiledning
Som i bowling foregår reaksjoner bare når effektive kollisjoner oppstår når det gjelder energi og veiledning Molekylære kollisjoner deler noe til felles med makroskopisk: de forekommer hovedsakelig mellom to arter eller kropper. To biljardkuler kolliderer med hverandre, i tillegg til en fotballball mot en vegg, eller to prosjektiler midt i luften. Det vil si at kollisjoner med hensyn til kjemi og dens reaksjoner har en tendens til å være bimolekylær type.
Kan tjene deg: ionisering i fysikk og kjemi: konsept, prosess og eksemplerMolekylene er ikke stille, men de beveger seg og roterer gjennom rommet som omgir dem. Ved å gjøre det antas det at de tegner en slags sirkel som kalles tverrsnitt, som det er sannsynligheten for at et annet colison -molekyl. På samme måte vurderer teorien at molekyler er sfæriske for å forenkle matematiske modeller.
To molekyler, hypotetisk sfærisk, kan kollidere uten problemer, selv om det ikke er noen kjemisk reaksjon. Men det skjer ikke på samme måte når det gjelder tre, fire eller flere molekyler.
Jo flere arter de bør kollidere for å stamme et produkt, jo mer usannsynlig blir fenomenet. Dette forklares visuelt å prøve at tre baller eller prosjektiler kolliderer samtidig sammen. Derfor er bimolekylære kollisjoner den desidert vanligste.
Systemer
Bare kollisjonsteori er gyldig for programvaresystemer eller faser. Dette er fordi gasser viser atferd som kan beskrives godt av deres kinetikk.
For flytende faser eller veldig fortynnede oppløsninger blir reaktive arter pakket inn i et løsningsmiddelmolekyler bur, som de også kolliderer. Dette endrer panoramaet, siden reaksjonene ikke bare avhenger av frekvensene til kollisjonene, men også av diffusjon av reaktantmolekylene gjennom mediet.
Kollisjonsenergier
Molekylene kan kollidere sakte eller veldig raskt. Dette avhenger av hvor stor energien, som igjen varierer betydelig med temperaturen. Jo sterkere kollisjonen, sannsynligheten for at det er en kjemisk reaksjon vil øke, siden denne energien kan bryte de nødvendige koblingene for å danne nye.
Kan tjene deg: monomererDenne energien er kjent som aktivering, ogTIL, Og det er karakteristisk for enhver kjemisk reaksjon. Når temperaturen øker, er gjennomsnittet av molekylene i stand til å matche eller overskride eTIL, Så antall effektive kollisjoner og derfor produktene som dannes, øker.
I nærvær av en katalysator ogTIL avtar, siden det gir overflater og elektroniske midler som fordeler kollisjoner. Resultatet: reaksjonshastigheten øker, uten å øke temperaturen eller tilsette andre reagenser.
Sterisk faktor
Kjemiske arter kolliderer effektivt for å reagere, og forutsi denne teorien hva som vil være hastigheten på reaksjonene deres. Eksperimenter har imidlertid vist at jo mer komplekse reagensstrukturer er, jo større er avvikene eller forskjellene mellom teoretiske og eksperimentelle hastigheter.
Dette er fordi molekylene er langt fra sfæriske, men romlig har alle slags geometrier. Det er her den steriske faktoren kommer inn, ρ, som den søker å korrigere reaksjonshastighetene slik at spådommene i teorien med de eksperimentelle resultatene er bedre.
Eksempler på reaksjoner
Bimolekylær reaksjon
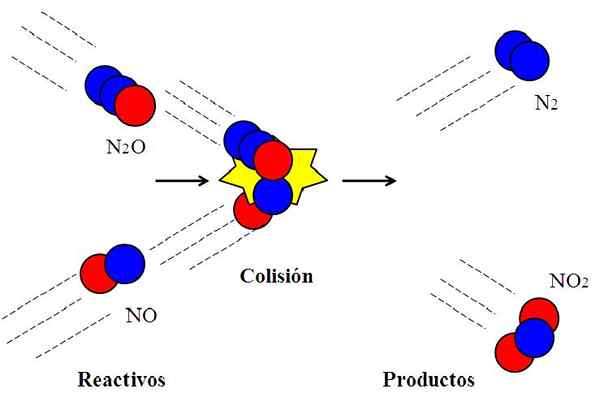 Effektiv kollisjon mellom nitrogenoksider. Kilde: Gabriel Bolívar.
Effektiv kollisjon mellom nitrogenoksider. Kilde: Gabriel Bolívar. Følgende reaksjon:
N2O + nei → n2 + NEI2
Det brukes ofte til å forklare hva effektiv orientering betyr i molekylære kollisjoner.
Molekylet n2Eller, dyitrogenoksid, vil det ikke reagere med NO, nitrogenoksid, med mindre under kollisjonen er oksygenatom (rød sirkel) til n2Eller sjokk direkte med nitrogenatom (blå sirkel) av nei. Bare på denne måten vil produktene n stammer fra2 og ikke2; Ellers n molekyler2O og de vil ikke sprette uten å reagere.
Kan tjene deg: Gassformstilstand: Kjennetegn, generell lov, eksemplerDette er et eksempel på en bimolekylær kollisjon for en elementær bimolekylær reaksjon. Selv når reagenser har nok energi til å bryte koblingene, hvis orienteringen ikke er passende, vil det ikke være noen kjemisk reaksjon.
Unimolekylær reaksjon
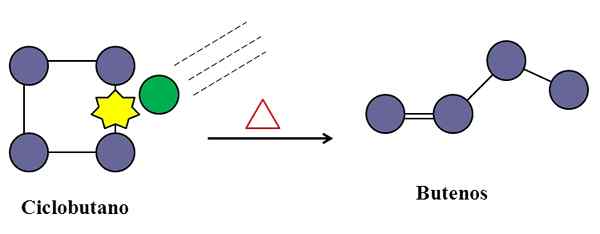 Kollisjoner er også uunnværlige for syklobutan -isomerisering. Kilde: Gabriel Bolívar.
Kollisjoner er også uunnværlige for syklobutan -isomerisering. Kilde: Gabriel Bolívar. I en unimolekylær elementær reaksjon kan molekylære kollisjoner også gripe inn, selv om det bare er en art som lider av transformasjonen eller sammenbruddet av koblingene.
Tenk for eksempel at isomeriseringen av syklobutanen gir opphav til en blanding av butaner. Når temperaturen øker, vil syklobutanmolekyler vibrere ved høyere frekvenser og kollidere med større kraft. Produktene viser imidlertid at to syklobutanmolekyler ikke reagerer på hverandre fordi ellers ville de produsere en forbindelse med åtte karbonatomer.
I midten kan det være urenheter (grønn sirkel), som også kolliderer med syklobutanen, spesielt på noen av C-C-koblingene. Disse kan være edle gasser, eller ikke veldig reaktive molekyler som nitrogen.
Det vil komme en tid hvor urenhet vil kollidere med tilstrekkelig energi til å bryte en av C-C-koblingene til syklobutanen. Og da vil molekylet forsøke å omorganisere og stamme en buuten, gjenkjennelig for dobbeltbindingen og den lineære kjedestrukturen.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Glasstone. (1970). Fysikjemi -traktat. Aguilar s. TIL. av utgaver, Juan Bravo, 38, Madrid (Spania).
- Walter J. Moore. (1962). Fysisk kjemi. (Fjerde utgave). Longmans.
- Wikipedia. (2020). Kollisjonsteori. Hentet fra: i.Wikipedia.org
- Redaktørene av Enyclopaedia Britannica. (2020). Kollisjonsteori. Britannica Encyclopaedia. Gjenopprettet fra: Britannica.com
- Clark Jim. (2018). Colision Theory of Reaction Rates. Gjenopprettet fra: Chemguide.co.Storbritannia
- Lawson s. & Nedre s. (18. mai 2020). Colision Theory. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Didaktiske tekstegenskaper, struktur, typer og eksempler
- Insular America eller Antilles land og egenskaper »

