Termokjemi

- 4712
- 76
- Theodor Anders Hopland
Vi forklarer at det er termokjemi, hvilke studier, dens lover og applikasjoner
 I termokjemien studeres varmeendringer i kjemiske reaksjoner
I termokjemien studeres varmeendringer i kjemiske reaksjoner Hva er termokjemi?
De Termokjemi Det er ansvarlig for studiet av varmemodifikasjonene som utføres i reaksjonene mellom to eller flere kjemiske arter. Det regnes som en essensiell del av termodynamikken, som studerer transformasjonen av varme og andre typer energi for å forstå retningen som prosessene utvikles i og hvordan energien varierer.
Det er også viktig å forstå at varmen innebærer overføring av termisk energi som oppstår mellom to kropper, når disse er ved forskjellige temperaturer; Mens termisk energi er assosiert med den tilfeldige bevegelsen som atomer og molekyler har.
Derfor, som nesten alle de kjemiske reaksjonene, blir energi absorbert eller frigjøres gjennom varme, er analysen av fenomenene som oppstår gjennom termokjemi veldig relevant.
Hva studerer termokjemi?
Termokjemien studerer varmen endrer seg i form av varme som oppstår i kjemiske reaksjoner eller når prosesser som innebærer fysiske transformasjoner oppstår.
I denne forstand må visse konsepter avklares i emnet for en større forståelse av det samme.
System
For eksempel refererer begrepet "system" til det spesifikke segmentet av universet som blir studert, og blir forstått som "univers" hensynet til systemet og omgivelsene (alt utenfor dette).
Så et system består vanligvis av arten som er involvert i de kjemiske eller fysiske transformasjonene som oppstår i reaksjoner. Disse systemene kan klassifiseres i tre typer: Åpne, lukket og isolert:
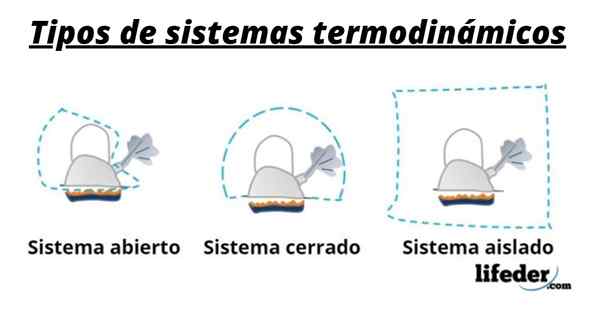
- Et åpent system er et som tillater overføring av materie og energi (varme) med omgivelsene.
- I et lukket system er det energiutveksling, men ikke av materie.
- I et isolert system presenteres ikke overføringen av materie eller energi i form av varme. Disse systemene er også kjent som "adiabatisk".
Termokjemi -lover
 Germain Hess, skaper av Hess's Law, grunnleggende for termokjemi
Germain Hess, skaper av Hess's Law, grunnleggende for termokjemi Lovene om termokjemi er nært knyttet til Laplace og Lavoisiers lov, samt Hess's Law, som er forløperne for den første loven i termodynamikk.
Prinsippet satt av den franske Antoine Lavoisier (viktig kjemisk og edelt) og Pierre-Simon Laplace (berømt matematiker, fysisk og astronom) gjennomgår at "endringen i energien som er manifestert i enhver fysisk eller kjemisk transformasjon har den samme og meningsfulle størrelsesorden i strid med endringen i energien til omvendt reaksjon ".
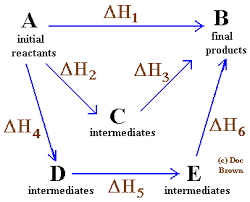
Hess lov
 Enkelt og generelt diagram der Hess -loven for fire kjemiske reaksjoner blir brukt
Enkelt og generelt diagram der Hess -loven for fire kjemiske reaksjoner blir brukt I samme ordensrekkefølge er loven formulert av den russiske kjemikeren fra Sveits, Germain Hess, en hjørnestein for forklaringen av termokjemi.
Dette prinsippet er basert på den.
Hess's lov kan kunngjøres på denne måten: "Den totale entalpien i en kjemisk reaksjon er den samme, om reaksjonen utføres i et enkelt trinn som om det skjer i en sekvens på flere trinn".
Total entalpi oppstår som subtraksjon mellom summen av entalpien av produkter bortsett fra summen av reaktantens entalpi.
Når det gjelder endring i standard entalpi av et system (i standardbetingelser på 25 ° C og 1 atm), kan det skjematiseres i henhold til følgende reaksjon:
Kan tjene deg: klorogensyreΔHreaksjon = ΣΔH(Produkter) - ΣΔH(reaktanter)
En annen måte å forklare dette prinsippet på, vel vitende om at endring av entalpi refererer til endring av varme i reaksjonene når de blir gitt til et konstant trykk, sier at endringen i netto entalpien til et system ikke avhenger av banen som den som følger mellom starttilstanden og slutten.
Første lov om termodynamikk
Denne loven er så iboende knyttet til termokjemien at den noen ganger er forvirret hvilken som inspirerte den andre; Så for å gi lys på denne loven, må man begynne med å si at den også har sine røtter i prinsippet om energibesparing.
Slik at termodynamikk ikke bare tar hensyn til varme som en form for energioverføring (for eksempel termokjemi), men også involverer andre former for energi, for eksempel indre energi (ELLER).
Så variasjonen i den interne energien til et system (ΔU) er gitt av forskjellen mellom dets første og endelige tilstander (som sett i Hess -loven).
Når man tar hensyn til at indre energi er sammensatt av kinetisk energi (partikkelbevegelse) og potensiell energi (interaksjoner mellom partikler) av det samme systemet, kan det trekkes ut at det er andre faktorer som bidrar til studiet av tilstanden og egenskapene til hvert system.
Termokjemi -applikasjoner
Termokjemien har flere applikasjoner, noen av disse vil bli nevnt nedenfor:
- Bestemmelse av energiforandringer i visse reaksjoner ved bruk av kalorimetri (måling av varmeforandringer i visse isolerte systemer).
- Fradrag for entalpiendringer i et system, selv om de ikke kan være kjent ved en direkte måling.
- Analyse av varmeoverføringer produsert eksperimentelt når organometalliske forbindelser med overgangsmetaller dannes.
- Studie av energitransformasjoner (i varme) gitt i forbindelser med koordinering av polyaminer med metaller.
- Bestemmelse av entalpiene til metall-oksygenkoblingen til ß-dics og ß-dics forenet til metaller.
- I tillegg til i tidligere applikasjoner, kan termokjemi brukes til å bestemme et stort antall parametere assosiert med andre typer energi- eller tilstandsfunksjoner, som er de som definerer statusen til et system på et gitt tidspunkt.
- Termokjemi brukes også i studiet av mange sammensatte egenskaper, som i titreringskalorimetri.
Referanser
- Wikipedia. (s.F.). Termokjemi. Innhentet fra.Wikipedia.org
- Chang, R. (2007). Kjemi, niende utgave. Mexico: McGraw-Hill.
- Librettexts. (s.F.). Termokjemi - en anmeldelse. Hentet fra Chem.Librettexts.org
- Tyagi, p. (2006). Termokjemi. Gjenopprettet fra bøker.Google.co.gå
- Ribeiro, m. TIL. (2012). Termokjemi og dens anvendelser til kjemiske og biokjemiske systemer. Hentet fra bøker.Google.co.gå
- Singh, n. B., Das, s. S., Og Singh,. K. (2009). Fysisk kjemi, bind 2. Gjenopprettet fra bøker.Google.co.gå

