Tioler
- 3638
- 21
- Theodor Anders Hopland
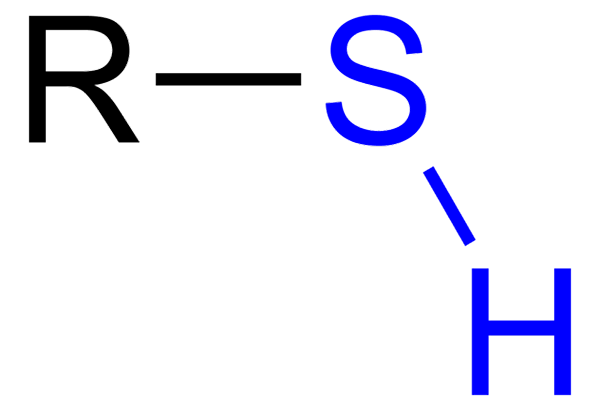
De Tioler De er organiske forbindelser som har en SH -gruppe, kalt Tiol eller Sulfihydrilo Group. Den generelle formelen er RSH, og kan representere R for en leie, en aryl eller annen kjemisk gruppe. Det særegne kjennetegnet ved thioles er dens sterke stinkende lukt.
Noen Thioles brukes til å formidle lukten av brennbare gasser, for å oppdage en lekkasje av disse gassene, som gitt deres karakteristikk kan være av stor fare. Tioler ligner på alkoholer, siden de har en OH -gruppe, mens Thioles en sh.
 Tiol med blå sulfhydrillo -gruppe
Tiol med blå sulfhydrillo -gruppe Imidlertid har de på sin side flere forskjeller: OH -gruppen er mer polar enn SH -gruppen, og svovel er et mindre atom enn oksygen og mindre elektronegativ.
Dette bestemmer at Thioles -molekyler ikke danner hydrogenbindinger eller vann eller blant dem. Derfor er løseligheten av tioler i vannet lav, og kokepunktet er lavere enn for alkoholer med en kjede med lignende karbonatomer.
Tioler er spesielt nyttige og hyppige i biokjemiske systemer, fordi flere tilsvarer biomolekyler, for eksempel koenzym til. S-H-bånd.
[TOC]
Tioles egenskaper
 Den stinkende aromaen av foten er hovedsakelig sammensatt av Thioles
Den stinkende aromaen av foten er hovedsakelig sammensatt av Thioles Generaliteter
OH -gruppen av alkoholer og SH -gruppen av Tioles deler et sett med fysiske og kjemiske egenskaper for å tilhøre oksygen og svovel til samme kjemiske gruppe av det periodiske tabellen (via gruppe).
Loa -tioéters, uniocetaler og tioésters, som er analoge med kjemiske forbindelser dannet av alkoholer, som etere, acetaler og estere. Imidlertid presenterer S-H- og O-H-koblinger noen forskjeller som vil gjenspeiles i egenskapene til Thioles og alkoholer.
Lukt
Et kjennetegn ved lav molekylvekt er dens ubehagelige lukt, ligner hvitløk og løk. Denne lukten er av en slik størrelse at den menneskelige lukten har en terskel på en del av tiolen for ti milliarder deler av luften.
Etanotiol tilsettes naturgass som et sikkerhetstiltak, for å oppdage enhver brennbar, men toalett unnslipper seg selv. Lukten av tioler avtar ved å øke antallet karbon i kjeden, fordi volatiliteten og andelen av Tiol -svovel reduseres.
Kan tjene deg: ammoniumfosfat: struktur, egenskaper, innhenting, brukKokepunkt og løselighet
S-H-koblingen til thiolene har et dipolmoment mindre enn O-H-koblingen til alkoholene. I tillegg er svovelatomet mindre og mindre elektronegativitet enn oksygenatom.
Dette bestemmer at Thioles -molekyler ikke kan danne hydrogenbindinger med vann eller blant dem, noe som forårsaker en forskjell mellom de fysiske egenskapene til tioler og alkoholer. For eksempel: Metanotiol (Cho3SH) har et kokepunkt på 6 ºC, mens metanol (Cho3Å) koker ved 65 ° C.
Ved romtemperatur (25 ºC) er metanol derfor en væske og metanotiol er en gass.
Oppsummert: Thioles har et lavere kokepunkt enn de tilsvarende alkoholene som presenteres. Av de samme grunnene er løseligheten av tioler i vannet og i andre polare løsningsmidler veldig lav. I mellomtiden er alkoholer med lav molekylvekt veldig løselig i vann.
Reaktivitet
S-H-koblingen er svakere enn O-H-bindingen, så Link S-H dissosierer lettere, noe som gjør tioler sterke syrer enn alkoholer. De fleste alkoholer har en PKA mellom 16 og 18, mens Thioles har en PKA rundt 11.
Dette tillater Thioles-): Et veldig sterkt nukleofilt middel.
SH-gruppen kan oksidere for å danne disulfider-koblinger (-s-s-) som er til stede i glutathionic oksidasjon: en tiol til stede i celler og har en antioksidantfunksjon.
Bromo eller andre halogener, så vel som oksygen, kan fungere på en tiol for å danne disulfur broer:
2 RSH +BR → R-S-S-R '+2 HBR
RSSR 'forbindelser er kjent som organiske sulfider og alkiiler, r2S.
På den annen side kan sterke oksidasjonsmidler, som natriumhypokloritt og hydrogenperoksyd, virke på thioles for å forårsake sulfonsyrer:
Rsh +h2ENTEN2 → RSO3H +3 h2ENTEN
Nomenklatur
IUPAC -nomenklaturen for Thioles er veldig lik den for alkoholer: navnet på Alkano som suffikset 'Tiol' blir lagt til ham.
Dermed kalles for eksempel Stano-avledet tistan 1-butanotiol, CH3Ch2Ch2Ch2SH, som indikerer med nummeret til SH -gruppen i karbonene i kjeden.
Kan tjene deg: kation: trening, forskjeller med anion og eksemplerPå samme måte er det en annen nomenklatur, igjen, ligner på alkoholer: ordet 'alkohol' erstattes av 'Mercaptan' i navnene på alkoholer. For eksempel Cho3SH, analog med metylalkohol, CH3Å, kalles metyl eller merkaptan Mercaptan.
Et annet eksempel ville være Cho3Ch2CH (sh) CH3, kalt 2-Butanotiol, Secbutilic Merchant eller Merchandise Secbutil. Det vil si at det legges vekt på identiteten til R i RSH -formelen. Derfor blir de andre normenes normer for alkoholer også oppfylt for Thioles.
Og til slutt, når SH -gruppen er til stede i en større struktur eller hvor de viktigste gruppene dominerer, brukes sulfihydrilo eller Mercapto -prefikset.
For eksempel sammensatt CH3Ch2Ch (sh) coch3 Det kalles 3-Mercapto-2-Penona. Legg merke til at SH har mindre prioritet enn oksygenerte grupper (bortsett fra eteren), så mindre tall tilsvarer det.
Syntese
En metode for syntese av tioler består av reaksjonen fra Tiota med et alkylhalogenid, som produserer et mellomliggende salt av isotiouron. Dette hydrolyseres ved natriumhydroksid for å oppnå tiol og urea.
Ch3SH blir fremstilt industrielt ved reaksjon av hydrogensulfid med metanol, i nærvær av syrekatalysatorer:
Ch3Oh +h2S → Ch3Sh +h2ENTEN
I en annen produksjonsmetode reagerte en alkylhalogenid med natriumhydrosulfuro:
RX +NASH → RSH +NAX
applikasjoner
Enzymfiksing koblet til nanopartikler
Tioler brukes som broer for å slå sammen nanopartikula-enzymkomplekser til gullelektroder. For eksempel brukes thiol.
Tiol -ingen reaksjon
Det er en organisk reaksjon mellom en tiol og en alken, som kaller en "klikk" -reaksjon; At det blant andre egenskaper er en høy ytelsesreaksjon, bredt omfang, som skaper eliminbar med -produkter med ikke -kromatografiske metoder, og det er også enkelt å utføre.
Tiol -ingen reaksjon har anvendelser i syntesen av Tioazúcar: sukker til stede i salicinol, en a -glykosidaseinhibitor. Salicinol er blitt isolert fra planter brukt på Sri Lanka og India i behandlingen av diabetes.
I tillegg brukes tiol -ingen reaksjon i kjemien til karbohydrater, polymeriseringer, overflatekjemi, syntesekjemi og kjemi av peptider.
Kan tjene deg: Frysingspunkt: Hvordan beregne det og eksemplerLuktstoffer
 Kjøkkengassen er toalett, men takket være sammensetningen av lav molekylvekt har den en særegen lukt
Kjøkkengassen er toalett, men takket være sammensetningen av lav molekylvekt har den en særegen lukt Alifatiske tioler med lav molekylvekt er innlemmet i naturgasser, slik at deres sterke lukt fungerer som en advarsel i møte med en flukt eller lekkasje av gass.
Medisin
Penicilamin (ca5HelleveNEI2S) Det er et medikament som brukes i behandlingen av Wilsons sykdom og revmatoid artritt.
Og captopril (c9HfemtenNEI3S), derimot, brukes det i behandlingen av arteriell hypertensjon og ved kongestiv hjertesykdom.
Begge er eksempler på Thioles med medisinske applikasjoner.
Biologisk
Tioles -grupper er til stede, blant andre forbindelser med biologisk funksjon, i cystein, koenzym A og glutathione.
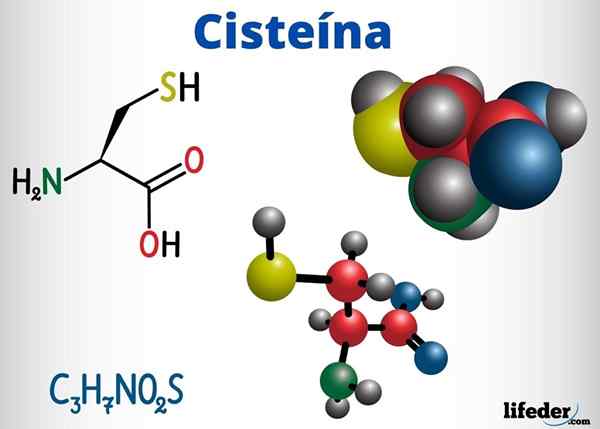
Cystein er en aminosyre som er i stand til å danne disulfur broer i proteinkjeden, og er derfor ansvarlig for den tertiære strukturen til et protein. Det kan også danne disulfur broer mellom forskjellige proteinkjeder, noe som forårsaker den kvartære strukturen til proteiner.
Cystein er lokalisert i de aktive sentrene for mange enzymer og har også en antioksidanthandling.
Glutation er en veldig viktig antioksidant intracellulær handling, og gir beskyttelse til celler og makromolekyler som utgjør den.
Koenzym A, derimot, er en tiol som griper inn i syntesen og oksidasjon av fettsyrer. I tillegg griper koenzym under form av acetylcoenzym A, griper inn i begynnelsen av sitronsyresyklusen eller Krebs -syklusen.
Eksempler
Til slutt vil noen navn på Thioles bli oppført ledsaget av deres molekylære formler:
-Tioeddiksyre (C2H4DU)
-Koenzym A (CtjueenH36N7ENTEN16P3S)
-Redusert glutasjon (C10H17N3ENTEN6S)
-Cystein (ca3H7NEI2S)
-Mercaptanol (ca2H6DU)
-Metanotiol (kap3Sh)
-1-propanotiol (c3H7Sh)
-Butanotiol (ca4H 9Sh)
-Tiofenol eller tiomerosal (c6H6S)
-Pomelo Mercaptano (C10H18S)
-Heksadekanotiol (ca6H3. 4S)
-Penicillamin (ca6HelleveNEI2S)
-Captopril (c9HfemtenNEI3S)
-Etanotiol (ca2H6S)
-2-propenetiol (c3H6S)
-Α-lipoic eller lipoamid (c8H14ENTEN2S2). Det er et syklisk disulfid.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Tiol. Hentet fra: i.Wikipedia.org
- Dr. Dietmar Kennepohl et al. (13. september 2020). Tioler og sulfider. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Redaktørene av Enyclopaedia Britannica. (2020). Tiol. Gjenopprettet fra: Britannica.com
- Nolan MD og Scanlan EM (2020) Applications of Thiol-Ene Chemistry for Peptide Science. Front. Chem. 8: 583272. Doi: 10.3389/fchem.2020.583272
- Dr. Carl c. Wamser. (1999). Kapittel 9: Alkoholer og tioler. Hentet fra: Web.PDX.Edu

