Treoninegenskaper, funksjoner, nedbrytning, fordeler
- 5018
- 1254
- Dr. Andreas Hopland
De Treonina (THR, T) eller TREO-a-amino-ß-butikkertsyre er en av de konstituerende aminosyrene av celleproteiner. Siden mennesker og andre virveldyr ikke har biosyntetiske ruter for produksjonen, regnes treonin som en av de 9 essensielle aminosyrene som må anskaffes med kostholdet.
Treonin var den siste av de 20 vanlige aminosyrene som ble oppdaget i proteiner, et faktum som skjedde i historien mer enn et århundre etter oppdagelsen av asparagin (1806), som var den første aminosyren beskrevet.
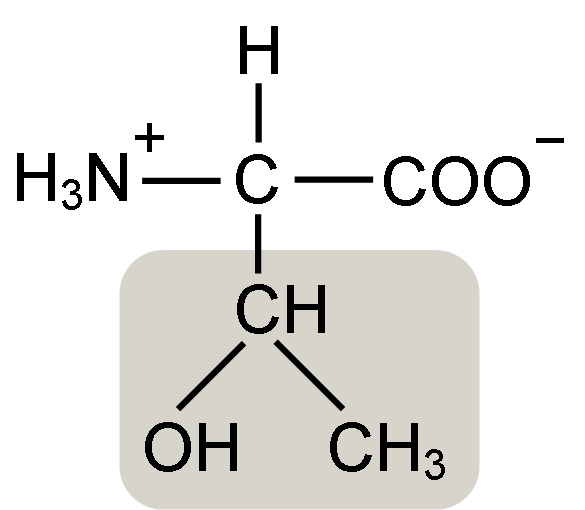
 Treonin aminosyrestruktur (kilde: Keycin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Treonin aminosyrestruktur (kilde: Keycin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) Det ble oppdaget av William Cumming Rose i 1936, som myntet begrepet "treonin" for den strukturelle likheten han fant mellom denne aminosyren og haraonsyre, en forbindelse avledet fra treosesukker.
Som aminosyreprotein har treonin flere funksjoner i cellene, hvorav bindingsstedet for karbohydratkjeder som er typiske for glykoproteiner og gjenkjennelsesstedet for proteinkinaser med spesifikke funksjoner (treoninproteiner/serinkinaser) ut).
Tilsvarende er treonin en essensiell komponent av proteiner som tannemalje, elastin og kollagen og har også viktige funksjoner i nervesystemet. Det brukes som mattilskudd og som en "avbøtende" av de fysiologiske tilstandene av angst og depresjon.
[TOC]
Kjennetegn
Treoninet tilhører den polare aminosyregruppen som har en R- eller sidekjedegruppe som mangler positive eller negative belastninger (ikke -belastede polare aminosyrer).
Egenskapene til R -gruppen er laget av en meget oppløselig aminosyre (hydrofil eller hydrofil), noe som også er sant for de andre medlemmene i denne gruppen, som cystein, serin, asparagin og glutamin.
Sammen med tryptofan, fenylalanin, isoleucin og tyrosin er treonin en av de fem aminosyrene som har både glukogene og ketogene funksjoner, fordi det fra metabolismen er relevante mellommenn som pyruvat og suksinyl -coa.
Denne aminosyren har en omtrentlig molekylvekt på 119 g/mol; Som mange av aminosyrene uten belastning, har den et isoelektrisk punkt rundt 5.87 og dens frekvens i proteinstrukturer er nær 6%.
Noen forfattere grupperer treoninet sammen med andre aminosyrer med "søt" smak, blant dem er for eksempel serin, glycin og alanin.
Struktur
Α-aminosyrer som treonin har en generell struktur, det vil si at det er vanlig for alle. Dette kjennetegnes ved tilstedeværelsen av et karbonatom kjent som "α -karbon", som er chiral og som fire typer molekyler eller forskjellige substituenter er forbundet.
Dette karbon deler en av bindingene med et hydrogenatom, en annen med R -gruppen, som er karakteristisk for hver aminosyre, og de to andre er okkupert av aminogruppene (NH2) og karboksyl (COOH), som er vanlig for alle Aminosyrene.
Toningruppen R har en hydroksylgruppe som lar den danne hydrogenbroer med andre molekyler i vandige medier. Identiteten kan defineres som en alkoholholdig gruppe (en etanol, med to karbonatomer), som har mistet et av sine hydrogener for å gå sammen med α (-chah-ch3) karbonatom.
Denne gruppen -OH kan tjene som en "bro" eller unionssted for en rekke molekyler (dette kan kobles sammen, for eksempel oligosakkaridekjeder under dannelse av glykoproteiner), så den er en av de som er ansvarlige for dannelsen av dannelsen av De modifiserte treoninderivater.
Den biologisk aktive formen for denne aminosyren er L-treonin, og det er dette som deltar både i dannelsen av proteinstrukturer og i de forskjellige metabolske prosessene der den virker.
Funksjoner
Som aminosyreprotein er treonin en del av strukturen til mange proteiner i naturen, der dens betydning og rikdom avhenger av identiteten og funksjonen til proteinet det tilhører.
Kan tjene deg: heterose: forbedring av dyr, i planter, menneskeI tillegg til dens strukturelle funksjoner i dannelsen av peptidsekvensen av proteiner, oppfyller treonin andre funksjoner både i nervesystemet og i leveren, hvor det deltar i metabolismen av fett og forhindrer akkumulering i dette organet i dette organet.
Treonin er en del av sekvensene som er anerkjent av enzymene serín/treonina kinaser, som er ansvarlige for en rekke proteinfosforyleringsprosesser, viktige for regulering av mangfoldighet av funksjoner og intracellulære signalhendelser.
Det brukes også til behandling av noen tarm- og fordøyelsesforstyrrelser og dens nytte ved dempningen av patologiske forhold som angst og depresjon er påvist.
L-treonin er også en av aminosyrene som kreves for å opprettholde den pluripotente tilstanden av musembryonale stamceller, et faktum som tilsynelatende er relatert til metabolismen av S-adenosyl-metionin og med metyleringshendelsene til histoner, som er direkte involvert i uttrykket av gener.
I bransjen
En fellesegenskap for mange aminosyrer er dens evne til å reagere med andre kjemiske grupper som aldehyder eller ketoner for dannelse av de karakteristiske "smaker" av mange forbindelser.
Blant disse aminosyrene er treoninet, som som serin, reagerer med sukrose under TOS.
Treonin er til stede i mange medisiner med naturlig opprinnelse og også i mange formuleringer av kosttilskudd som er foreskrevet til pasienter med underernæring eller som har dårlige dietter i denne aminosyren.
En annen av de mest beryktede funksjonene til L-treonin, og det har vokst over tid, er additiv i tilberedningen av konsentrert mat for griser og fjørfeproduksjonsindustrier.
L-treonin brukes i disse næringene som et mattilskudd i dårlige formuleringer fra proteinet synspunkt, siden dette gir økonomiske fordeler og lindrer de rå proteinmangelene som disse gårdsdyrene konsumerer.
Hovedformen for produksjon av denne aminosyren er normalt ved mikrobiell gjæring og verdensproduksjonstall for landbruksformål for år 2009 oversteg 75 tonn.
Biosyntese
Treonin er en av de ni essensielle aminosyrene for mennesket, noe som betyr at det ikke kan syntetiseres av kroppsceller, og derfor må du skaffes fra proteiner av dyr eller planteopprinnelse som leveres med det daglige kostholdet.
Planter, sopp og bakterier syntetiserer treonin fra lignende ruter som kan presentere noen avvik med hverandre. Imidlertid starter de fleste av disse organismer fra Asparto som en forløper, ikke bare for treonin, men også for metodin og lysin.
Biosintetisk rute i mikrober
Biosyntese-ruten til L-treonin i mikroorganismer som bakterier består av fem trinn katalysert av forskjellige enzymer. Avgangssubstratet, som kommentert, er aspartatet, som fosforyleres av et enzym ATP-avhengig quinasa aspartat.
Denne reaksjonen produserer metabolit L-Asphat-fosfat (L-Apartil-P) som fungerer som et underlag for den semiiadehydiske aspartylenzymdehydrogenasen, som katalyserer omdannelsen til semi-avhengig semi-avholdende aspartyl.
Semiiardhaide aspartyl kan brukes både til biosyntesen av L-lisin og for biosyntesen av L-treonin; I dette tilfellet brukes molekylet av et homoserin-enzym NADPH-avhengig avhengighet for produksjon av L-homoserina.
L-homoserinet fosforyleres til L-homoserin fosfat (L-homoserina-P) av et homoserin ATP-avhengig kinase og nevnte reaksjonsprodukt, i sin tur, er et underlag av syntasetreonin-enzym, i stand til å syntetisere L-trinina.
L-metionin kan syntetiseres fra L-homoserin produsert i forrige trinn, så det representerer en "konkurransedyktig" rute for syntese av L-treonin.
Den syntetiserte L-treonin på denne måten kan brukes til proteinsyntese eller kan også brukes nedstrøms for syntese av glycin og L-leucin, to relevante aminosyrer også fra proteinet synspunkt.
Kan tjene deg: evolusjonsteorierRegulering
Det er viktig å fremheve at tre av de fem enzymene som deltar i biosyntesen av L-treonin i bakterier, er regulert av produktet av reaksjonen ved negativ tilbakemelding. Dette er kinase -aspartatet, homoserindehydrogenase og homoserin -kinasen.
I tillegg avhenger reguleringen av denne biosyntetiske ruten også av de cellulære kravene til de andre biosyntetiske produktene relatert til den, siden dannelsen av L-lisin, L-metionin, L-isoleucin og glycin er avhengig av produksjonsveien for produksjonen av L-treonin.
Nedbrytning
Treonin kan nedbrytes ved to forskjellige ruter for å produsere pyruvat eller succinyl-CoA. Det siste er det viktigste produktet av treoninkatabolisme hos mennesker.
Treonin metabolisme forekommer hovedsakelig i leveren, men bukspyttkjertelen, selv om det i mindre grad deltar i denne prosessen. Denne ruten begynner med transport av aminosyren gjennom plasmamembranen til hepatocyttene ved hjelp av spesifikke transportører.
Pyruvatproduksjon fra treonin
Konvertering av treonin til pyruvat skjer takket være den.
Hos mennesket representerer denne ruten bare mellom 10 og 30% av katabolismen til treoninet, men dens betydning er i forhold til organismen som blir vurdert siden, for eksempel, for eksempel, er dette mye mer relevant katabolisk å snakke.
Succinil-CoA-produksjon fra Treonina
Som med Metionine, Valina og isoleucin, brukes også karbonatomer i treonin for succunil-CoA-produksjon. Denne prosessen begynner med konvertering av aminosyren til a-metobutirat, som deretter brukes som et underlag av a-Zo-Stoat dehydrogenase-enzym for å utføre propionil-CoA.
Transformasjonen av treonin til a-metobutirat katalyseres av enzymet dehydratase, noe som innebærer tap av et vannmolekyl (H2O) og et annet av et ammoniumion (NH4+).
Propionyl-CoA er karboksylert i metylmalonyl-CoA gjennom en totrinns reaksjon som krever inntreden av et bikarbonatkarbonatom (HCO3-). Dette produktet fungerer som et underlag for et metylmalonil-CoA mutasa-koenzym B12-avhengig, som "epimeriserer" molekylet for å produsere succinyl-CoA.
Andre katabolske produkter
I tillegg kan karbonskjelettet til treonin katabolsk brukes til produksjon av acetyl-CoA, som også har viktige implikasjoner fra energisynet i kroppsceller.
I visse organismer fungerer treonin også som et underlag av noen biosyntetiske ruter som isoleucin, for eksempel. I dette tilfellet, gjennom 5 katalytiske trinn, kan a-ekthobutirat avledet fra katabolismen av treonin rettes mot dannelsen av isoleucin.
Mat rik på treonin
Selv om de fleste av de rike matvarene i protein har en vis.
Treonin er også i dyrekjøtt som kylling, gris, kanin, lam og forskjellige typer fugler. I mat med planteopprinnelse er det rikelig i kullene, på løk, hvitløk, chard og auberginer.
Det finnes også i ris, mais, hvetekli, belgfrukter og i mange frukt som jordbær, bananer, druer, ananas, plommer og andre nøtter rike på protein som nøtter eller pistasjnøtter, blant andre.
Fordelene med inntaket ditt
I følge komiteen for eksperter fra Verdens helseorganisasjon for landbruk og mat (WHO, FAO), er Treoninas daglige krav til et gjennomsnittlig voksent menneske rundt 7 mg per kilo kroppsvekt, som må anskaffes fra matinntak med kosthold.
Kan tjene deg: Rød av fenol: Kjennetegn, forberedelser, applikasjonerDisse tallene stammer fra eksperimentelle data hentet fra studier utført med menn og kvinner, der denne mengden treonin er tilstrekkelig til å få en positiv nitrogenbalanse i kroppsceller.
Studier med barn mellom 6 måneder og ett år har imidlertid vist at for disse er minimumskravene til L-treonin mellom 50 og 60 mg per kilo vekt per dag.
Blant de viktigste fordelene med inntaket av kosttilskudd eller medisiner med spesielle formuleringer rike på L-treonin er behandlingen av lateral amyotrof sklerose eller Lou Gehrig-sykdom.
Ytterligere treoninforsyning favoriserer absorpsjon av næringsstoffer i tarmen og bidrar også til forbedring av leverfunksjoner. Det er også viktig for transport av fosfatgrupper gjennom celler.
Mangelforstyrrelser
Hos små barn er det fødte defekter i treoninmetabolisme som forårsaker vekstforsinkelse og andre relaterte metabolske lidelser.
Mangler i denne aminosyren har vært assosiert med noen feil i vektøkning av barn, i tillegg til andre patologier relatert til mangelen på nitrogenretensjon og tap i urin.
Mennesker utsatt for dårlige dietter i Treonina kan ha en større tilbøyelighet til å lide av fet lever og noen tarminfeksjoner relatert til denne aminosyren.
Referanser
- Barret, g., & Elmore, D. (2004). Aminosyrer og peptider. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Oh s. H., Condon, m., & Young, V. R. (2002). Treoninbehov hos friske voksne, avskjærte med 24-timers indikator amininosyrebalanseteknikk. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, h. (1931). Historien om oppdagelsen av aminosyrene. Ii. En gjennomgang av aminosyrer beskrevet siden 1931 som komponenter av naturlige proteiner. Fremskritt innen proteinkjemi, 81-171.
- Champe, s., & Harvey, r. (2003). Aminosyrer aminosyrer. I Lippincotts illustrerte anmeldelser: biokjemi (3rth Ed., pp. 1-12). Lippincott.
- De Lange, C. F. M., Gillis, a. M., & Simpson, G. J. (2001). Påvirkning av treonininntak på hvem-kroppsproteinavsetning og treoninbruk hos voksende griser matet rensede dietter. Journal of Animal Science, 79, 3087-3095.
- Edelman, a., Blumenthal, d., & Krebs, og. (1987). Serin/treoninkinaseprotein. Annu. Rev., 56, 567-613.
- Edsall, J. (1960). Aminosyrer, proteiner og biokjemi for kreft (Vol. 241). London: Academic Press, Inc.
- Hus, j. D., Hall, b. N., & Brosnan, J. T. (2001). Treonin metabolisme i isolerte hepatocytter. American Journal of Physiology - Endokrinologi og metabolisme, 281, 1300-1307.
- Hudson, f. (1992). Biokjemi av matproteiner. Springer-Science+Business Media, B.V.
- Kaplan, m., & Flavin, m. (1965). Treonin biosyntese. På veien i sopp og bakterier og mekanismen for isomeriseringsreaksjonen. Journal of Biological Chemistry, 240(10), 3928-3933.
- Kidd, m., & Kerr, B. (nitten nittiseks). L-Threonine for fjærkre: en anmeldelse. Applied Poultry Science, Inc., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, p., & Holt, og. (1954). Treoninbehovet til det normale spedbarnet. Journal of Nutrition, 10(56), 231-251.
- Rigo, J., & Senterre, J. (1980). Optimalt treonininntak for premature infering Fed på oral eller parenteral ernæring. Journal of Parenteral and Enteral Nutrition, 4(1), 15-17.
- Shyh-Chang, n., Locasale, J. W., Lysssiotis, ca. TIL., Zheng, og., Teo, r. OG., Ratanasirintrawoot, s.,... Cantley, l. C. (2013). Påvirkning av treoninmetabolisme på S-adensylmetionin og histonmetylering. Vitenskap, 339, 222-226.
- Vickery, h. B., & Schmidt, c. L. TIL. (1931). Historien om oppdagelsen av aminosyrene. Kjemiske anmeldelser, 9(2), 169-318.
- MD Web. (n.d.). Hentet 10. september 2019, fra www.Webmd.com/vitaminer/ai/ingrediensmono-1083/treonin
- Wormser, e. H., & Pardee, til. B. (1958). Regulering av treoninbiosyntese i Escherichia coli. Arkiv for biokjemi og biofysikk, 78(2), 416-432.
- Xunyan, x., Quinn, p., & Xiaoyuan, x. (2012). Forskningsport. Hentet 10. september 2019, fra www.ResearchGate.Net/figur/The-Biosynthesis-Rase-of-L-Threonine-the-staway-Consists-of-Fi-Ve-enzymmatic-Steps_Fig1_232320671

