Svoveltrioksid (SO3) struktur, egenskaper, risikoer, bruk
- 4473
- 773
- Oliver Christiansen
Han Svoveltrioksid Det er en uorganisk forbindelse dannet av foreningen av et svovelatom (er) og 3 oksygenatomer (O). Den molekylære formelen er slik3. Ved romtemperatur, SO3 Det er en væske som gir av gasser i luften.
Strukturen til SO3 Gassformig er flat og symmetrisk. De tre oksygenene ligger rettferdig rundt svovelen. SO3 Reagerer voldsomt med vann. Reaksjonen er eksotermisk, noe som betyr at det blir produsert varme, med andre ord, mye blir oppvarmet.
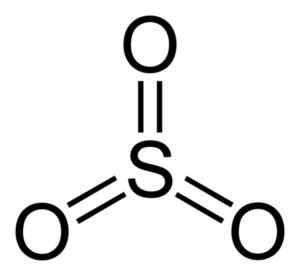 Svoveltrioksidmolekyl så3. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Svoveltrioksidmolekyl så3. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Når SO3 Væske avkjøles, det blir et solid som kan ha tre typer struktur: alfa, beta og gamma. Den mest stabile er alfaen, i form av lag sammen med hverandre som utgjør et nettverk.
Gassøs svoveltrioksid brukes til å fremstille røyking av svovelsyre, også kalt olje, på grunn av olje eller fet stofflig likhet. En annen av de viktige bruksområdene er i sulfonering av organiske forbindelser, det vil si tilsetning av grupper -så3- til disse. Dermed kan nyttige kjemikalier fremstilles som vaskemidler, fargestoffer, plantevernmidler, blant mange andre.
SO3 Det er veldig farlig, det kan forårsake alvorlige forbrenninger, øyne og hudskader. Det skal heller ikke innhales eller inntakes fordi det kan forårsake død ved indre forbrenninger, i munnen, spiserøret, magen, etc.
Av disse grunner må det manipuleres med stor forsiktighet. Du bør aldri kontakte vann eller brennbare materialer som tre, papir, stoffer osv., Vel, brann kan produseres. Det skal heller ikke kastes eller kloakk på grunn av faren for eksplosjon.
SO3 Gasser som genereres i industrielle prosesser skal ikke frigjøres til miljøet, siden det er en av de ansvarlige for surt regn som allerede har skadet store utvidelser av skoger i verden.
[TOC]
Struktur
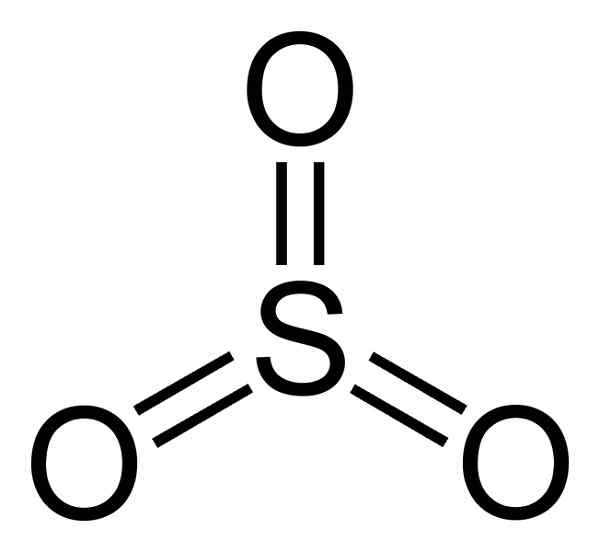
Svoveltrioksidmolekylet så3 I gassformig har den en flat trekantet struktur.
Dette betyr at både svovel og tre oksygen finnes i samme plan. I tillegg er fordelingen av oksygen og alle elektroner symmetrisk.
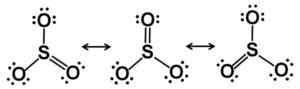 Lewis Resonance Starcutures. Elektroner er rettferdig distribuert i SO3. Forfatter: Marilú Stea.
Lewis Resonance Starcutures. Elektroner er rettferdig distribuert i SO3. Forfatter: Marilú Stea. I fast tilstand er tre typer So -struktur kjent3: Alfa (α-so3), beta (β-so3) og gamma (γ-så3).
Gamma-formen γ-SO3 inneholder sykliske trimmere, det vil si tre enheter av SO3 Sammen danner et syklisk eller ringformet molekyl.
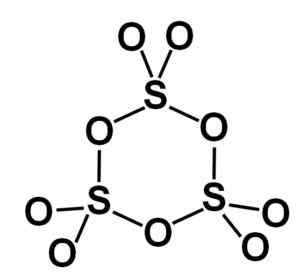 Ringmolekyl av den faste svoveltrioksid -gamma. Forfatter: Marilú Stea.
Ringmolekyl av den faste svoveltrioksid -gamma. Forfatter: Marilú Stea. Beta β-så fase3 Den har uendelige spiralformede kjeder av sammensetning tetrahedra så4 forent med hverandre.
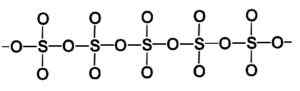 Struktur av en solid svoveltrioksid -beta. Forfatter: Marilú Stea.
Struktur av en solid svoveltrioksid -beta. Forfatter: Marilú Stea. Den mest stabile måten er alfa α-so3, Ligner på beta, men med en lagstruktur, med United Chains som danner et nettverk.
Nomenklatur
-Svoveltrioksid
-Svovisk anhydrid
-Svoveloksid
-SW3 Gamma, γ-SO3
-SW3 beta, β-so3
-SW3 Alfa, α-so3
Fysiske egenskaper
Fysisk tilstand
Ved romtemperatur (rundt 25 ºC) og atmosfæretrykk, SO3 Det er en fargeløs væske som avgir røyk i luften.
Når SO3 Væske er ren ved 25 ºC er en blanding av SO3 monomer (et enkelt molekyl) og trimerisk (3 bundne molekyler) av formel s3ENTEN9, også kalt det3 Gamma γ-SO3.
Kan tjene deg: Rankine Scale: Hva er, konverteringer, eksemplerNår du senker temperaturen, hvis SO3 Det er rent når den når 16,86 ºC, den stivner eller fryser y-SO3, også kalt "så is3"".
Hvis den inneholder små mengder fuktighet (til og med ekstremt små spor eller mengder) SO3 Polymeriserer beta ß-så3 som danner krystaller med en silkeaktig lysstyrke.
Da dannes flere fagforeninger ved å generere a-SO-strukturen3, som er et krystallinsk fast stoff i form av nåler som ligner asbest eller asbest.
Når alfa og beta smelte genererer gamma.
Molekylær vekt
80,07 g/mol
Smeltepunkt
SW3 Gamma = 16,86 ºC
Trippelpunkt
Det er temperaturen som de tre fysiske tilstandene er til stede: fast, flytende og gassformig. I alfa -formen er trippelpunktet på 62,2 ºC og i betaen er det på 32,5 ºC.
Ved å varme opp alfaformen har dette en større tendens til å sublimisere enn å smelte. Sublimimar betyr å flytte fra fast tilstand til brus direkte, uten å gå gjennom flytende tilstand.
Kokepunkt
Alle former for SO3 Kok ved 44,8 ºC.
Tetthet
SO3 Væske (gamma) har en tetthet på 1 9225 g/cm3 ved 20 ºC.
SO3 Gassøs har en tetthet på 2,76 i forhold til luften (luft = 1), noe som indikerer at den er tyngre enn luften.
Damptrykk
SW3 ALFA = 73 mm Hg ved 25 ºC
SW3 Beta = 344 mm Hg ved 25 ° C
SW3 Gamma = 433 mm Hg ved 25 ºC
Dette betyr at gammaformen har en tendens til å fordampe lettere enn betaen, og dette som alfaen.
Stabilitet
Alfaformen er den mest stabile strukturen, de andre er metastabile, det vil si at de er mindre stabile.
Kjemiske egenskaper
SO3 reagerer energisk med vann for å gi svovelsyre h2SW4. Når du reagerer, er det veldig varme slik at vanndamp raskt løsnes fra blandingen.
Blir utsatt for luft So3 absorbere fuktighet raskt, og slipper ut tette damper.
Det er et veldig sterkt dehydratiserende middel, dette betyr at det eliminerer vann lett fra andre materialer.
Svovel av SO3 Den har en affinitet for frie elektroner (det vil si elektroner som ikke er i en kobling mellom to atomer), så det har en tendens til å danne komplekser med forbindelser som har dem som pyridin, trimetylamin eller dioksan.
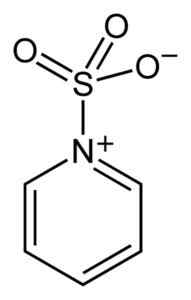 Kompleks mellom svoveltrioksid og pyridin. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
Kompleks mellom svoveltrioksid og pyridin. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. Ved å danne komplekser tar svovel "lånt" elektronene til den andre forbindelsen for å tilfredsstille deres mangel på disse. Svoveltrioksid er fremdeles tilgjengelig i disse kompleksene, som brukes i kjemiske reaksjoner for å gi SO3.
Det er et kraftig sulfonantreagens av organiske forbindelser, noe som betyr at det tjener til å tilsette en gruppe -så3- Til molekylene.
Det reagerer lett med oksydene fra mange metaller for å gi sulfater av disse metallene.
Det er etsende mot metaller, dyre- og plantevev.
SO3 Det er et vanskelig materiale å håndtere av flere grunner: (1) Kokepunktet er relativt lavt, (2) har en tendens til å danne faste polymerer ved temperaturer mindre enn 30 ºC og (3) har en høy reaktivitet mot nesten alle organiske stoffer Og vannet.
Kan tjene deg: amorfe faste stoffer: struktur, egenskaper, eksemplerDet kan eksplosivt polymerisere hvis den ikke inneholder en stabilisator og det er fuktighetssted for tilstedeværelse. Som stabilisatorer brukes dimetylsulfat eller boroksid.
Å skaffe
Det oppnås ved reaksjonen ved 400 ºC mellom svoveldioksid SO2 og molekylært oksygen eller2. Reaksjonen er imidlertid veldig langsom og katalysatorer er pålagt å øke hastigheten på dette.
2 Så2 + ENTEN2 ⇔ 2 Så3
Blant forbindelsene som akselererer denne reaksjonen er Platino Metal PT, Vanadium Pentoxide V2ENTEN5, Jern oksid2ENTEN3 og nitrogenoksid.
applikasjoner
I oljeforberedelse
En av hovedanvendelsene består i fremstilling av olje- eller røyksvovelsyre, kalt fordi den avgir synlige damper til det blotte øye. For å få det, blir SO absorbert3 I konsentrert svovelsyre H2SW4.
 Pu -sulfuric oleum eller røyking. Du kan se den hvite røyken komme ut av flasken. W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Pu -sulfuric oleum eller røyking. Du kan se den hvite røyken komme ut av flasken. W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Dette gjøres i spesielle tårn i rustfritt stål der konsentrert svovelsyre (som er flytende)3 Gassformig går opp.
Væske og gass kommer i kontakt og blir med, og danner oleum som er en fet utseende væske. Dette har en blanding av h2SW4 Og så3, men det har også disulfurinsyre molekyler h2S2ENTEN7 og Trisulfuric H2S3ENTEN10.
I kjemiske sulfoneringsreaksjoner
Sulfonering er en nøkkelprosess i industrielle applikasjoner med store og skala for fremstilling av vaskemidler, overflateaktive midler, fargestoffer, plantevernmidler og farmasøytiske produkter.
SO3 Det fungerer som et sulfonantmiddel for å fremstille sulfonede oljer og alkyl-angal-sulfonerte vaskemidler, blant mange andre forbindelser. Nedenfor er sulfoneringsreaksjonen til en aromatisk forbindelse:
Arh + så3 → Arso3H
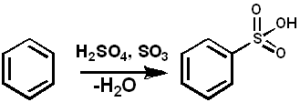 Benzensulfonasjon med så3. Pedro8410 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Benzensulfonasjon med så3. Pedro8410 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. For sulfoneringsreaksjoner kan oleum eller så brukes3 I form av komplekser med pyridin eller trimetylamin, blant andre.
I metallekstraksjon
Gass s3 Det har blitt brukt i behandlingen av mineraler. Enkle metalloksider kan bli mye mer oppløselige sulfater når du behandler dem med SO3 ved relativt lave temperaturer.
Svovelmineraler som pyritt (jernsulfid), kanal3 Tillater disse metallene enkelt og til lave kostnader.
Jern, nikkel og kobbersulfider reagerer med så gass3 Selv ved romtemperatur, danner de respektive sulfatene, som er veldig løselige og kan bli utsatt for andre prosesser for å oppnå rent metall.
I flere bruksområder
SO3 Det tjener til å fremstille klorosulfurinsyre også kalt klorosulfonsyre HSO3Cl.
Svoveltrioksid er en veldig kraftig oksidant og brukes i eksplosiv produksjon.
Risiko
Til helse
SO3 Det er en svært giftig forbindelse av alle ruter, det vil si innånding, inntak og hudkontakt.
Irrita og korroderer slimhinner. Forårsaker hud og øyne. Dampene hans er veldig giftige når de blir inhalert. Indre forbrenninger produseres, pustevansker, smerter i brystet og lungeødem.
Kan tjene deg: Butanone: Struktur, egenskaper og bruk Svoveltrioksid SO3 er veldig etsende og farlig. Forfatter: Openicons. Kilde: Pixabay.
Svoveltrioksid SO3 er veldig etsende og farlig. Forfatter: Openicons. Kilde: Pixabay. Det er giftig. Inntaket genererer alvorlig forbrenning, spiserør og mage. I tillegg er det mistenkt at det er kreftfremkallende.
Brann eller eksplosjon
Det representerer brannfare når du kommer i kontakt med organiske materialer som tre, fibre, papir, olje, bomull, blant andre, spesielt hvis de er våte.
Det er også risiko hvis du kommer i kontakt med baser eller reduserer midler. Det er kombinert med eksplosivt vann, og danner svovelsyre.
Kontakt med metaller kan produsere hydrogengass h2 som er veldig brannfarlig.
Det bør unngås i glassfartøy for å forhindre mulig voldelig brudd på beholderen.
Miljøpåvirkning
SO3 Det regnes som en av de største miljøgiftene som er til stede i jordens atmosfære. Dette skyldes sin rolle i dannelsen av aerosoler og dets bidrag til surt regn (på grunn av dannelsen av svovelsyre H2SW4).
 Skog skadet av surt regn i Tsjekkia. Lovecz [offentlig domene]. Kilde: Wikimedia Commons.
Skog skadet av surt regn i Tsjekkia. Lovecz [offentlig domene]. Kilde: Wikimedia Commons. SO3 Det dannes i atmosfæren på grunn av oksidasjon av svoveldioksid så2. Når SO er dannet3 Dette reagerer raskt med vann for å danne svovelsyre H2SW4. I følge nyere studier er det andre SOS -transformasjonsmekanismer3 I atmosfæren, men på grunn av den store mengden vann som er til stede i denne, blir SO fortsatt vurdert3 Hovedsakelig konvertert til h2SW4.
SO3 Gass eller industriell gass avfall som inneholder det skal ikke lastes ned til atmosfæren fordi det er en farlig forurensning. Det er en ekstremt reaktiv gass, og som allerede har blitt sagt ovenfor, i nærvær av fuktighet av luften So3 Det blir svovelsyre h2SW4. Derfor, i luften So3 vedvarer i form av svovelsyre som danner små dråper eller aerosol.
Hvis svovelsyredråper kommer inn i luftveiene til mennesket eller dyren, vokser de raskt på grunn av fuktighet som er til stede der, så de har muligheten for å trenge gjennom lungene. En av mekanismene med syretåken til h2SW4 (Det er slik3) Det kan produsere sterk toksisitet er fordi den ekstracellulære og intracellulære pH i levende organismer (planter, dyr og menneske) endrer endringer).
Ifølge noen forskere, så tåke3 Det er årsaken til økningen i astmatikere i et område av Japan. Tåken av det3 Det har en veldig etsende effekt på metaller, slik at metallstrukturene er bygget av mennesket som noen broer og konstruksjoner kan bli veldig påvirket.
SO3 væske skal ikke kastes i drenering av skittent vann eller kloakk. Hvis det helles i kloakkene, kan du skape ild- eller eksplosjonsfare. Hvis det blir sølt ved et uhell, bør en strøm av vann ikke rettes mot produktet. Det skal aldri tas opp i sagflis eller annet absorberende drivstoff, da det kan generere branner.
Det skal tas opp i tørr sand, tørt land eller annet helt tørr inert absorberende. SO3 Det skal ikke helles i miljøet og skal aldri komme i kontakt med dette. Det bør holdes langt fra vannkilder fordi med dette produserer svovelsyre som er skadelig for vannlevende og landorganismer.
Referanser
- Sarkar, s. et al. (2019). Påvirkning av ammoniakk og vann på skjebnen til svoveltrioksid i troposfæren: Teoretisk forskning av sulfaminsyre og svovelsyreformasjonsveier. J Phys Chem a.2019; 123 (14): 3131-3141. NCBI kom seg.NLM.NIH.Gov.
- Muller, t.L. (2006). Svovelsyre og svoveltrioksid. Kirk-Ohmer Encyclopedia of Chemical Technology. Volum 23. Hentet fra online bibliotek.Wiley.com.
- ELLER.S. National Library of Medicine. (2019). Trioxide Sulphur. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Kikuchi, r. (2001). Miljøhåndtering av svoveltrioksidimisjon: Effekt av SO3 På menneskers helse. Miljøstyring (2001) 27: 837. Lenke gjenopprettet.Springer.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Ismail, m.Yo. (1979). Ekstraksjon av metaller fra sulfider ved bruk av svoveltrioksid i fluidisert seng. J. Chem. TECH. Biotechnol. 1979, 29, 361-366. Hentet fra online bibliotek.Wiley.com.
- « Malawi Lago Geography, Geology, Viktighet, Fauna, Rios
- Natriumcyanid (NaCN) struktur, egenskaper, risikoer, bruk »

