Natriumcyanid (NaCN) struktur, egenskaper, risikoer, bruk

- 2713
- 311
- Prof. Oskar Aas
Han Natriumcyanid Det er et uorganisk salt dannet av et natriumna -kation+ og en cyanidanion CN-. Dens kjemiske formel er NACN. Også kjent som natriumcyanid, det er et hvitt krystallinsk fast stoff. Det er hygroskopisk, det vil si at det absorberer vann fra miljøet, og krystaller er kubisk som natriumklorid -NaCl.
Når det oppløses i vann, har det en tendens til å danne HCN -hydrogensyanid. Løsningene hans løses lett og sølv opp. Denne funksjonen gjør at den brukes til å trekke ut gull og sølv fra sineralene. Løsningene som brukes til dette formålet blir resirkulert, det vil si at de gjenbrukes flere ganger.
 Natriumnatriumnatriumcyanid. L26 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Natriumnatriumnatriumcyanid. L26 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Noen cyanid klarer imidlertid å unnslippe visse avfallsdammer, som representerer en fare for fauna og menneske, fordi cyanid er veldig giftig og kan forårsake død.
NACN brukes i den kjemiske industrien som mellomledd for å fremstille flere typer forbindelser, for eksempel fargestoffer, kjemikalier for landbruk og medisiner eller medisiner.
Natriumcyanid er en veldig farlig forbindelse fordi det kan forårsake død, så det må manipuleres med ekstrem forsiktighet.
[TOC]
Struktur
Natriumcyanid dannes av en ion Na+ og en ion CN-.
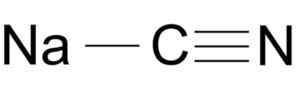 Natriumcyanidmolekylstruktur NACN. ArrowSmaster [Public Domain], Kilde: Wikimedia Commons.
Natriumcyanidmolekylstruktur NACN. ArrowSmaster [Public Domain], Kilde: Wikimedia Commons. Cyanidionet har en bilbil og en av Nitrogen n samlet av hverandre med en trippelkobling.
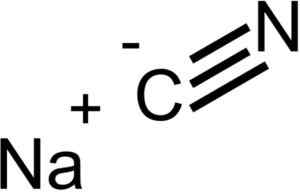 Ioner som utgjør natriumcyanid NACN. EPOP [Public Domain]. Kilde: Wikimedia Commons.
Ioner som utgjør natriumcyanid NACN. EPOP [Public Domain]. Kilde: Wikimedia Commons. NaCn har den samme krystallinske strukturen som NaCl, så krystallene er kubikk.
Nomenklatur
-Natriumcyanid
-Natriumcyanid
Egenskaper
Fysisk tilstand
Hygroskopisk hvitt krystallinsk fast stoff (absorberer vann fra miljøet).
Molekylær vekt
49,007 g/mol
Smeltepunkt
563,7 ºC
Kokepunkt
1496 ºC
Flashpoint
Det er ikke brannfarlig. Men hvis det blir utsatt for en brann, oppstår HCN hydrogencyanid og nitrogenoksider.
Kan tjene deg: sublimering: konsept, prosess og eksemplerTetthet
1.595 g/cm3 ved 20 ºC
Løselighet
Veldig løselig i vann: 48 g/100 ml ved 10 ºC, 82 g/100 ml ved 35 ° C. Litt løselig i alkohol
Dissosiasjonskonstant
Det hydrolyseres i vandig oppløsning som genererer HCN -hydrogencyanid. Konstanten ved denne hydrolysen er kh = 2,5 x 10-5.
Ph
NaCn vandige oppløsninger er sterkt alkalisk
Kjemiske egenskaper
Når den oppløses i vann, skiller det seg i NA -ionene+ og CN-. I vandig løsning cyanidion CN- Ta en proton h+ vann h2Eller danner HCN og et OH -ion-, Så løsningen blir alkalisk.
CN- + H2O → HCN + OH-
Av denne grunn dekomponerer deres vandige oppløsninger raskt ved å forbli lagret, og danner HCN -hydrogensyanid.
Det er etsende mot aluminium. Løsningene løser lett au og sølv AG i nærvær av luft.
Det er et chelateringsmiddel fordi cyanidanionen CN- Det kan lett bli sammen med andre metaller, som sølv, gull, kvikksølv, sink, kadmium, etc.
Presenterer en svak lukt av bitre mandler.
Risiko
Må håndteres veldig nøye. Det er en meget giftig forbindelse, hemmer viktige metabolske prosesser og fører til død både for inntak, inhalasjon, hudabsorpsjon eller øyekontakt.
Hvis NACN blir inhalert, oppløses den i slimhinnen i luftveiene og passerer til blodomløpet. Cyanidionet til NACN har en sterk affinitet for jern i en oksidasjonstilstand på +3, det vil si den jernholdige kationen tro3+.
Når cyanid blir absorbert, reagerer det raskt med tro3+ av et viktig enzym av mitokondriene i cellene (oksidase -cytokrom), og forhindrer at visse pusteprosesser utføres.
Derfor blir cellulær respirasjon hemmet eller bremsing og er cytotoksisk hypoksi. Det betyr at celler og vev ikke er i stand til å bruke oksygen, spesielt hjerne- og hjerteceller.
På denne måten oppstår permanent eller dødelig skade på kroppen. Dette kan skje både hos mennesker og dyr.
Hvis overbelastningen av blodkar og korrosjon av mageslimhinnen inntar, inntar i tillegg til det som allerede er nevnt.
Kan tjene deg: Justus von Liebig Natriumcyanid NACN kan forårsake død. Forfatter: Openicons. Kilde: Pixabay.
Natriumcyanid NACN kan forårsake død. Forfatter: Openicons. Kilde: Pixabay. Det er ikke drivstoff, men i kontakt med syrer frigjør det HCN som er svært brennbar og giftig.
Hvis det smelter med nitritter eller klorater, kan det utnytte.
Å skaffe
Det kan oppnås med natrium Na, ammoniakk NH3 og kull c. Natrium reagerer med ammoniakk som gir natrium nanh2:
2 Na + 2 NH3 → 2 nanh2 + H2↑
Natriumamid varmes opp med karbon ved 600 ºC og produserer natriumcyanamid NA2NCN, som da med kull ved 800 ° C blir natriumcyanid:
2 Nanh2 + C → 2 H2↑ + Na2Ncn
Na2NCN + C → 2 NACN
En annen metode er å smelte kalsium og kullcyanamid C med natriumkarbonat NA2Co3:
CANCN + C + NA2Co3 → Caco3 + 2 NACN
Det kan også tilberedes ved å passere nitrogengass n2 for en varm blanding av natriumkarbonat2Co3 og kull C pulverisert, ved å bruke troens tro som en katalysator eller akselerator for reaksjonen:
Na2Co3 + 4 C + N2 → 2 NACN + 3 CO ↑
applikasjoner
I utvinning av gull- og sølvmineraler. Konsekvenser
Natriumcyanid har blitt brukt i lang tid for å trekke ut gull- og sølvmetaller fra sineralene.
Cyanidet som brukes i prosessen blir resirkulert, men noe slipper unna avfallsdammen sammen med tungmetaller som ikke er utvunnet.
Fugler, flaggermus og andre dyr som drikker fra disse lagunene med cyanid er blitt forgiftet.
Det er registreringer av en Romania Dam som holdt en avfallsdam isolert og ble skadet av en værhendelse.
Som en konsekvens ble tonn cyanid frigjort til Sasar -elven og akvifersystemene i nærheten som Lapus, Somes, Tisza Rivers, som endte i Donau.
Dette forårsaket et fossefall av dyredødsfall, eller med andre ord, en økologisk katastrofe.
 Gullekstraksjon med cyanid i New Zealand rundt 1918. Du kan se mengden forurenset vann, som ble utskrevet i elvene i nærheten. National Library NZ on the Commons [ingen begrensninger]. Kilde: Wikimedia Commons.
Gullekstraksjon med cyanid i New Zealand rundt 1918. Du kan se mengden forurenset vann, som ble utskrevet i elvene i nærheten. National Library NZ on the Commons [ingen begrensninger]. Kilde: Wikimedia Commons. I produksjonen av andre kjemiske forbindelser
Natriumcyanid NACN brukes i syntesen av forskjellige typer organiske forbindelser.
Kan tjene deg: natriumoksid (Na2O): struktur, formel, egenskaper, risikoerFor eksempel er pigmenter og fargestoffer fremstilt (inkludert optiske poleringsmidler), forbindelser for bruk i landbruk eller agrokjemikalier og forskjellige farmasøytiske produkter.
Det tjener også til å skaffe chelatering eller kidnappingsmidler av metallioner.
Med natriumcyanid tilberedes forbindelsene som kalles nitriler, som når de blir behandlet med syresyre eller alkalisk vandig løsning, gjør det å oppnå karboksylsyrer.
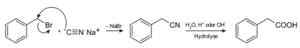 Fremstilling av en karboksylsyre ved bruk av natriumcyanid NACN. Roland Mattern [Public Domain]. Kilde: Wikimedia Commons.
Fremstilling av en karboksylsyre ved bruk av natriumcyanid NACN. Roland Mattern [Public Domain]. Kilde: Wikimedia Commons. Det gjør det mulig å tilberede fettsyrer med cyano -grupper, tungmetallcyanider og hydrogensyanid HCN.
I metallindustrien
NACN brukes i løsningene som brukes i galvanoplastikk eller metallelektrode (metallbelegg med andre) for eksempel sink.
Det er en komponent av herdet stål. Det tjener også i rengjøring av metaller.
I andre bruksområder
Natriumcyanid er en mellomledd i produksjonen av nylon.
Det brukes til å skille mineraler ved flotasjon med skum.
Applikasjoner uten bruk, avhørt eller veldig sjelden
Nasjonen ble brukt til å eliminere gnagere, for eksempel kaniner og rotter og gravene deres, og for å avslutte termitter reir.
Det brukes for øyeblikket av og til for å eliminere coyoter, rever og ville hunder. Det brukes i form av kapsler som enkle eller flere doser i beiteområder, jakt og skog.
På grunn av sin ekstreme toksisitet, må NACN bare brukes av forberedte mennesker.
Denne bruken anses som veldig farlig for mennesket, men det er de som fremdeles bruker den.
 Villlivet skal ikke elimineres, ettersom disse dyrene allerede kjemper for å overleve under vanskelige forhold. Forfatter: Maxwdhs. Kilde: Pixabay.
Villlivet skal ikke elimineres, ettersom disse dyrene allerede kjemper for å overleve under vanskelige forhold. Forfatter: Maxwdhs. Kilde: Pixabay. I landbruket ble det tidligere brukt til å fumre sitrusfrukttrær og andre frukter. Det ble også brukt som et insektmiddel og miticid (middeliminator) som skulle brukes etter høsting, for ikke -lagret sitrus eller for å tømme lastebiler som ble brukt til å transportere dem. Det ble også brukt til å fumre skip, jernbanebiler og lager.
Alle disse bruksområdene har blitt stilt spørsmål ved den høye toksisiteten til natriumcyanid. Av denne grunn brukes det ikke lenger eller bare veldig sjelden og under veldig kontrollerte forhold.
Referanser
- ELLER.S. National Library of Medicine. (2019). Natriumcyanid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Hurst, h.OG. og Martin, m.D. (2017). Toksikologi. Cyanid. I farmakologi og terapeutikk for tannbehandling (syvende utgave). Gjenopprettet fra Scientedirect.com.
- Coppock, r.W. og Dziwenka, m. (2015). Trusler mot dyreliv av kjemiske krigføringsmidler. I Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Gjenopprettet fra Scientedirect.com.
- Morrison, r.T. og Boyd, r.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- « Svoveltrioksid (SO3) struktur, egenskaper, risikoer, bruk
- Bariumoksyd (BAO) struktur, egenskaper, bruksområder, risikoer »

