Wolfram historie, egenskaper, struktur, bruker

- 3190
- 401
- Magnus Sander Berntsen
Han wolfram, Wolframio eller volframium er et tungt overgangsmetall hvis kjemiske symbol er w. Det ligger i periode 6 med gruppe 6 i det periodiske tabellen, og atomnummeret er 74. Hans navn har to etymologiske betydninger: hard stein og ulveskum; Det andre er fordi dette metallet også er kjent som Wolframio.
Det er et sølvgrå metall, og selv om det er skjørt, har stor hardhet, tetthet og høy fusjon og kokepunkter. Derfor har det blitt brukt i alle de applikasjonene som involverer høye temperaturer, trykk eller mekaniske krefter, for eksempel øvelser, prosjektiler eller stråling av stråling.
 Wolframstang med sin delvis oksiderte overflate. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Wolframstang med sin delvis oksiderte overflate. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Den mest kjente bruken for dette metallet, på et kultur og populært nivå, er i filamentene til de elektriske pærene. Som har manipulert dem, vil innse hvor skjøre de er; De er imidlertid ikke laget av ren wolfram, som er formbar og duktil. I tillegg, i metallmatriser som legeringer, gir det utmerket motstand og hardhet.
Det karakteriseres og kjennetegnes ved å være metallet med det høyeste fusjonspunktet, og for også å være tettere enn den samme ledningen, bare overgått av andre metaller som osmium og iridium. Det er også det tyngste metallet som er kjent for å møte en biologisk rolle i kroppen.
I de fleste av dens ioniske forbindelser deltar wolframstatanionen, wo42-, som kan polymerisere for å forårsake klynger i et surt medium. På den annen side kan wolfram danne intermetalliske forbindelser, eller sterisere med metaller eller uorganiske salter slik at faste stoffer får forskjellige former eller konsistenser.
Det er ikke veldig rikelig i jordens cortex, og har som massevis av det bare 1,5 gram av dette metallet. I tillegg, fordi det er et tungt element, er opprinnelsen intergalaktisk; Spesielt av eksplosjonene til supernovaene, som måtte kaste "jetfly" av wolframatomer til planeten vår under deres formasjon.
[TOC]
Historie
Etymologi
Historien til wolfram eller wolframio har to ansikter så vel som navnene deres: den ene sveitsiske, og den andre tyske. På 1600 -tallet, i regioner som for tiden er okkupert av Tyskland og Østerrike, arbeidet gruvearbeiderne med kobber- og tinnekstraksjoner for å produsere bronser.
Da møtte gruvearbeiderne en torn i prosessen: det var et ekstremt vanskelig mineral; Mineral besto av wolframite, (tro, mn, mg) wo4, som beholdt eller "slukt" tinn som om det var en ulv.
Derav etymologien for dette elementet, 'ulv' av ulv på spansk, en ulv som spiste tinn; og 'ram' av skum eller krem, hvis krystaller lignet en lang svart pels. Det var slik at navnet 'Wolfram' eller 'Wolframio' dukket opp til ære for disse første observasjonene.
I 1758, på sveitsisk side til et lignende mineral, Scheelita, Cawo4, Han ble kalt 'Tung Sten', som betyr 'Hard Stone'.
Både navn, Wolframio og wolfram, er mye brukt om hverandre, avhengig utelukkende av kultur. I Spania, for eksempel, og i det europeiske vesten, er dette metallet kjent mer av Wolframio; Mens det er på det amerikanske kontinentet, dominerer navnet.
Anerkjennelse og oppdagelse
Det ble da kjent at det mellom det syttende og attende århundre var to mineraler: Wolframite og Scheelita. Men som skimtet at det var et annet metall enn de andre? De kunne bare karakteriseres som mineraler, og det var i 1779 at den irske kjemikeren Peter Woulfe nøye analyserte Wolframite og trakk eksistensen av Wolframium.
Det kan tjene deg: perbromsyre (HBRO4): Egenskaper, risikoer og bruksområderPå den sveitsiske siden, igjen, var Carl Wilhelm Scheele i 1781 i stand til å isolere wolframen som wo3; Og enda mer oppnådde han tumatisk (eller wolframisk) syre, h2Wo4 og andre forbindelser.
Dette var imidlertid ikke nok til å nå rent metall, fordi det var nødvendig å redusere denne syren; det vil si utsett det for en slik prosess som ikke kan oksygen og krystallisere som metall. Carl Wilhelm Scheele hadde ikke passende metodikk for denne kjemiske reduksjonsreaksjonen.
Det er her de spanske brødrene D'Aluyar, Fausto og Juan José, som reduserte begge mineralene (Wolframite og Scheelita) med kull, i byen Bergara, i byen Bergara. To får fortjeneste og ære for å være oppdagere av Wolframium eller metallisk wolfram (W).
Stål og pærer
 Enhver pære med wolframfilament. Kilde: Pxhere.
Enhver pære med wolframfilament. Kilde: Pxhere. Som andre metaller definerer bruken av historien. Blant de mest fremtredende ved slutten av 1800-tallet var ståltungstenoer og wolframfilamenter for å erstatte karbon inne i de elektriske pærene. Det kan sies at de første pærene, som vi kjenner dem, ble markedsført i 1903-1904.
Egenskaper
Fysisk utseende
Det er et sølv og skinnende grått metall. Skjør, men av stor hardhet (ikke forvirrende med iherdighet). Hvis stykket er av høy renhet, blir det formbart og hardt, både eller flere og flere stål.
Atomnummer
74.
Molmasse
183,85 g/mol.
Smeltepunkt
3422 ºC.
Kokepunkt
5930 ºC.
Tetthet
19,3 g/ml.
Fusjonsvarme
52,31 kJ/mol.
Fordampningsvarme
774 kJ/mol.
Molar varmekapasitet
24,27 kJ/mol.
Moh hardhet
7.5.
Elektronegativitet
2,36 på Pauling -skalaen.
Atomisk radio
139
Elektrisk resistivitet
52.8 nΩ · m ved 20 ºC.
Isotoper
Den presenterer hovedsakelig i naturen som fem isotoper: 182W, 183W, 184W, 186W og 180W. I henhold til molmassen på 183 g/mol, som gjennomsnitt er atommassene til disse isotoper (og de andre tretti radioisotoper), har hvert atom av wolfram eller wolframium omtrent hundre og ti nøytroner (74 + 110 = 184).
Kjemi
Det er et svært motstandsdyktig mot korrosjonsmetall, som det tynne laget av wo3 beskytter det mot angrepet av oksygen, syre og alkalier. Når de er oppløst og utfelt med andre reagenser, oppnås saltene sine, som kalles wolframater eller wolgstates; I dem har wolfram en oksidasjonstilstand på +6 (forutsatt at det er kationer w6+).
Syre klynging
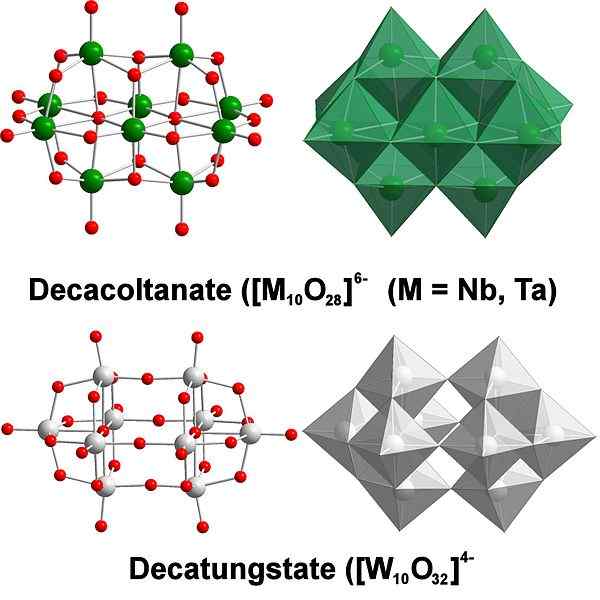 Decatungstate, et eksempel på wolfram polyaxomethalates. Kilde: Scifanz [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Decatungstate, et eksempel på wolfram polyaxomethalates. Kilde: Scifanz [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Kjemisk er wolframen ganske spesiell fordi ionene har en tendens til å være gruppert (gruppering på engelsk) for å danne heteropolycider eller polyaxomethalate. Hva er de? De er grupper eller klynger av atomer som binder seg for å definere en tredimensjonal kropp; Hovedsakelig en med sfærisk burstruktur, der de "omslutter" et annet atom.
Det hele starter fra wolframstate anion, wo42-, Som i surt medium er protonet (hwo4-) og knyttet til en nærliggende anion for å danne [w2ENTEN7(ÅH)2]2-; Og dette blir igjen sammen med en annen [w2ENTEN7(ÅH)2]2- Å stamme [w4ENTEN12(ÅH)4]4-. Så videre til i løsning det er flere polytungstater.
Kan tjene deg: litiumklorid (LICL): Egenskaper, risikoer og bruksområderParathungstate a og b, [w7ENTEN24]6- og h2W12ENTEN4210-, henholdsvis er de en av de mest fremragende av disse polyadene.
Det kan bli en utfordring å vurdere sin skisse- og Lewis -strukturer; Men det er i prinsippet nok å visualisere dem som wo octaedra setter6 (Øvre bilde).
Legg merke til at disse gråaktige oktaedraene ender opp med å definere Decatungstate, en Politungstate; Hvis en heteroátomo låser seg inne (for eksempel fosfor), ville det være en polyaxomethalate.
Elektronisk struktur og konfigurasjon
Krystallinske faser
Wolframatomer definerer en kubikkstruktur sentrert med kroppen (BCC, av Kroppssenteret kubikk). Denne krystallinske formen er kjent som α -fasen; Mens β -fasen også er kubikk, men litt tett. Både faser eller krystallinske former, α og β, kan sameksistere i balanse under normale forhold.
De krystallinske kornene i α -fasen er isometriske, mens de i β -fasen ligner kolonnene. Uansett hvordan glasset er, i denne regjeringen. Ellers kunne ikke de høye smelte- og kokepunktene forklares, eller den høye hardheten og tettheten av wolfram.
Metallkobling
Wolframatomer må på en eller annen måte være veldig forent. For å heve en formodning, bør den elektroniske konfigurasjonen av dette metallet observeres før:
[Xe] 4f145 d46s2
5D orbitaler er veldig store og uskarpe, noe som vil innebære at mellom to nære atomer w er det effektive orbitaloverlapp. Også Orbitals 6s bidrar til de resulterende bandene, men i mindre grad. Mens 4F -orbitalene har "veldig dypt ned" og deres bidrag til den metalliske koblingen er lavere.
Dette, størrelsen på atomene og de krystallinske korn, er variablene som bestemmer hardheten til wolfram og dens tetthet.
Oksidasjonsstater
I wolfram eller metallisk wolframium har atomene w null oksidasjonstilstand (w0). Tilbake til elektronisk konfigurasjon, kan 5D og 6S orbitaler "tømme" elektroner avhengig av om W er i selskap med veldig elektronegative atomer, for eksempel oksygen eller fluor.
Når de to 6S -elektronene går tapt, har wolfram oksidasjonstilstand +2 (w2+), Hva som genererer at atomkontrakten.
Hvis du også mister alle elektronene til 5D -orbitalene dine, vil oksidasjonsstatusen din bli +6 (w6+); Herfra kan det ikke bli mer positivt (i teorien), siden 4F -orbitalene for å være indre vil kreve store energier for å fjerne elektronene sine. Det vil si at den mest positive oksidasjonstilstanden er +6, der wolfram ennå har liten.
Denne wolframen (VI) er veldig stabil under sure forhold eller i mange oksygenerte eller halogenerte forbindelser. Andre positive og mulige oksidasjonstilstander er: +1, +2, +3, +4, +5 og +6.
Tungsten kan også få elektroner hvis de kombineres med mindre elektronegative atomer enn ham. I dette tilfellet blir atomene deres større. Det kan få maksimalt fire elektroner; det vil si, ha en oksidasjonstilstand på -4 (w4-).
Å skaffe
Tidligere ble det nevnt at wolfram finnes i Wolframite og Scheelita mineraler. Avhengig av prosessen oppnås to forbindelser fra dem: wolframoksid, wo3, eller ammoniumparatungstate, (nh4)10(H2W12ENTEN42) · 4H2O (eller ATP). Noen av dem to kan reduseres til metallisk W med kull over 1050 ºC.
Det kan tjene deg: Raault Law: Prinsipp og formel, eksempler, øvelserDet er ikke økonomisk lønnsomt. Det er grunnen til at det foretrekkes å produsere det i form av støv for en gang å takle andre metaller for å få legeringer.
Det er verdt å nevne at Kinas verden er landet med den største produksjonen av wolfram. Og på det amerikanske kontinentet, Canada, Bolivia og Brasil, okkuperer de også listen over de største produsentene av dette metallet.
applikasjoner
 En wolframkarbidforbindelse: Et eksempel på hvordan hardheten i dette metallet kan brukes til å forevige og herde materialer. Kilde: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
En wolframkarbidforbindelse: Et eksempel på hvordan hardheten i dette metallet kan brukes til å forevige og herde materialer. Kilde: Solitaryangel (Solitaryangel) [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Noen av de kjente bruksområdene for dette metallet er nevnt nedenfor:
-Saltene hans ble brukt til å fargelegge bomull av gamle teatre antrekk.
-Kombinert med stål herder den enda mer, selv å kunne motstå mekaniske kutt i høye hastigheter.
-Wolframsinterende filamenter har blitt brukt i mer enn hundre år i elektriske pærer og halogenerte lamper. På grunn av det høye smeltepunktet har det tjent som materiale for katodestrålrør, og for rakettmotorer dyser.
-Erstatter bly i produksjonen av prosjektiler og radioaktive skjold.
-Tungsten nanocables kan brukes i pH -følsom nanodispositiv.
-Tungsten -katalysatorer ble brukt til å håndtere svovelproduksjon i oljeindustrien.
-Tungsten -karbid er fra alle forbindelsene som dekker mer bruk. Fra styrking av kutt og boreverktøy, eller fremstilling av militære våpenstykker, for å mekanisere tre, plast og keramikk.
Risiko og forholdsregler
Biologisk
Å være et relativt sjeldent metall i jordskorpen, er dets negative effekter knapp. I sure jordarter kan det hende at polytungstater ikke påvirker enzymene som brukes av molybdater; Men i grunnleggende jordsmonn, wo42- Det griper inn (positivt eller negativt) i MOOs metabolske prosesser42- og kobber.
Plantene kan for eksempel absorbere de oppløselige forbindelsene til wolfram, og ved å spise dem et dyr og deretter etter å ha konsumert kjøttet, kommer W -atomer inn i organismer. De fleste blir utvist i urin og avføring, og lite er kjent hva som skjer med resten av dem.
Dyreforsøk viste at når høye konsentrasjoner av wolframpulver utvikler symptomer som ligner på lungekreft.
Ved svelging vil et voksen menneske måtte drikke tusenvis av liter vann beriket med wolframsalter for å vise betydelig hemming av kolinesterase og fosfatase -enzymer.
Fysisk
Generelt sett er wolfram et lite giftig element, og det er derfor få vertsrisikoer for helseskader.
Når det gjelder metallisk wolfram, bør du unngå å puste støvet; Og hvis prøven er solid, må det tas i betraktning at den er veldig tett og at det kan forårsake fysisk skade hvis den faller eller treffer andre overflater.
Referanser
- Bell Terence. (s.F.). Tungsten (Wolfram): Egenskaper, produksjon, applikasjoner og legeringer. Balansen. Gjenopprettet fra: TheBalance.com
- Wikipedia. (2019). Wolfram. Hentet fra: i.Wikipedia.org
- Lentech b.V. (2019). Wolfram. Gjenopprettet fra: Lentech.com
- Jeff Desjardins. (1. mai 2017). Historien til wolfram, det sterkeste naturlige metallet på jorden. Gjenopprettet fra: VisualCapitalist.com
- Doug Stewart. (2019). Tungsten Element Facts. Gjenopprettet fra: Chemicool.com
- Art Fisher og Pam Powell. (s.F.). Wolfram. University of Nevada. Gjenopprettet fra: unce.a r.Edu
- Helmestine, Anne Marie, PH.D. (2. mars 2019). Wolfram eller wolfram fakta. Gjenopprettet fra: Thoughtco.com

