Kaliumoksid (K2O)
- 1487
- 197
- Markus Fredriksen
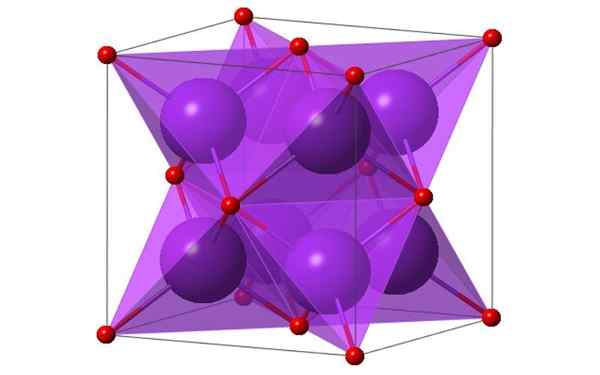
 Kubisk design av 4 molekyler av kaliumoksyd. Kilde: Ktlabe, Wikimedia Commons
Kubisk design av 4 molekyler av kaliumoksyd. Kilde: Ktlabe, Wikimedia Commons Hva er kaliumoksyd?
Han Kaliumoksyd, Også kalt dipotasiumoksid, det er et ionisk oksygen og kaliumsalt, med formel k2ENTEN. Det er det enkleste kaliumoksydet, svært reaktivt og sjelden funnet. Noen handelsmaterialer, for eksempel gjødsel og sement2ENTEN.
Kaliumoksyd produseres fra kaliumhydroksyd (kaustisk potassa) og 450 ° C metallisk kalium, og produserer molekylært hydrogen i henhold til ligningen:
2K + 2KOH ⇌ 2K2Eller + h2 (450 ° C).
Det oppnås også ved å redusere kaliumperoksyd i henhold til reaksjonen:
2k2ENTEN2 → K2Eller + o2 (530 ° C).
En annen metode for å oppnå kaliumoksyd er ved å varme opp kaliumkarbonat ved høy temperatur, som indikert med følgende reaksjon:
K2Co3 ⇌ k2O + CO₂ (T> 1200 ° C).
Imidlertid er den viktigste måten å oppnå kaliumoksyd ved oppvarming av kaliumnitrat, oppnå molekylært nitrogen som indikert ved følgende reaksjon:
2kno3 + 10K → 6K2Eller + n2
Fysiske og kjemiske egenskaper
- De er tetraedrale krystaller, gulaktige, uten karakteristisk aroma.
- Den har en molekylvekt på 94,2 g/mol og en tetthet på 2,13 g/ml ved 24 ° C.
- Den har et smeltepunkt på 740 ° C, selv om det begynner å dekomponere ved 300 ° C.
- Det er motstandsdyktig mot varme og løselig i etanol og eter. K2Eller krystalliserer i antifluorittstrukturen. Av denne grunn investeres posisjonene til anionene og kationene i forhold til deres posisjoner i CAF2, med koordinerte kaliumioner til 4 ioner av oksyd- og oksidioner koordinert ved 8 kalium.
- Det er et grunnleggende oksid og reagerer med vann voldsomt for å produsere kaustisk kaliumhydroksid. Det er delikoserende og absorberer vann fra atmosfæren, og starter denne kraftige reaksjonen.
Det kan tjene deg: Kalsiumnitrat (CA (NO3) 2)- Det oksiderer reversibelt til kaliumperoksyd ved 350 ° C, reagerer voldsomt med syrer, for eksempel saltsyre, for å danne kaliumsalter i henhold til reaksjonen:
K2O + 2HCL → 2KCL + H₂O.
- Reagerer med nitrogendioksid for å danne nitrat og kaliumnitritt ved temperaturer mellom 150 og 200 ° C:
K2O + 2no2 = Kno2 + Kno3
- Reagerer ved lave temperaturer med ammoniakk for å danne amidas og kaliumhydroksyd i henhold til reaksjonen:
K2O + NH3 (L) → KNH2↓ + KOH (-50 ° C).
Risiko
Kaliumoksyd er et ustabilt stoff. Oksiderer enkelt annet kalium-, peroksyd- eller kaliumsyre (KHO) oksider (KHO). Forbindelsen er ikke drivstoff, men den reagerer kraftig og eksotermisk med vann for å danne kaliumhydroksyd (KOH).
Kaliumoksydløsning i vann er en sterk base, reagerer voldsomt med syre og er etsende. Reagerer voldsomt med vann som produserer kaliumhydroksid. Angriper mange metaller i nærvær av vann.
Stoffet er etsende for øyne, hud og luftveier, samt ved å innta. Aerosolinhalering kan forårsake lungeødem, hvis symptomer ofte blir manifestert etter noen timer, og forverres av fysisk innsats.
I tilfelle øyekontakt, må du bekrefte om kontaktlinser brukes og fjerne dem umiddelbart. Øynene skal vaskes med rennende vann i minst 15 minutter, med åpne øyelokk. Kaldt vann kan brukes, og ikke et øyesalve.
Hvis kjemikaliet kommer i kontakt med klærne, beholder det så raskt som mulig, og beskytter egne hender og kropp. Plasser offeret under en sikkerhetsdusj.
Hvis kjemikaliet akkumuleres i den utsatte huden, for eksempel hendene, vaskes huden forurenset med rennende vann og ikke -slimrende såpe mykt og forsiktig. Kaldt vann kan brukes. Hvis irritasjon vedvarer, må du søke lege. Vask forurensede klær før du bruker det igjen.
Det kan tjene deg: Rubidio: Historie, egenskaper, struktur, innhenting, brukHvis hudkontakt er alvorlig, bør den vaskes med en desinfiserende såpe og dekke huden forurenset med en antibakteriell krem.
I tilfelle innånding, bør offeret få lov til å stå i et godt ventilert område. Hvis innånding er alvorlig, må offeret evakueres til et trygt område så snart som mulig.
Løsne tette klær, for eksempel skjortehals, belter eller slips. Hvis offeret er vanskelig å puste, må oksygen administreres. Hvis offeret ikke puster, blir det laget en gjenopplivning av munnen.
Når du alltid tar i betraktning at det kan være farlig for personen som gir hjelp til å gi munn til munnen gjenopplivning når det inhalerte materialet er giftig, smittsomt eller etsende.
Ved inntak induserer det ikke oppkast. Løsne de stramme klærne. I alle tilfeller bør det søkes øyeblikkelig legehjelp.
applikasjoner
- Den kjemiske formelen k2Eller (eller bare k) brukes i flere industrielle sammenhenger: N-P-K-tall for gjødsel, sementformler og glassformler.
Det brukes ofte ikke direkte i disse produktene, men mengden kalium rapporteres i form av K -ekvivalent2Eller for alle typer kaliumforbindelser som brukes, for eksempel kaliumkarbonat.
- Kaliumoksyd er omtrent 83% av kalium i vekt, mens kaliumklorid bare er 52%. Kaliumklorid gir mindre kalium enn en like stor mengde kaliumoksyd.
Derfor, hvis en gjødsel er 30% kaliumklorid etter vekt, vil dens standard kaliumindeks, basert på kaliumoksyd, bare være 18,8%. Den er produsert og/eller mellom 10 og 100 tonn per år av dette stoffet i det europeiske økonomiske rommet.
Kan tjene deg: Kjemi i hverdagen: +30 Eksempler- Dette stoffet brukes i laboratoriekjemikalier, gjødsel, polymerer og fytosanitære produkter. K2O Den har industriell bruk som resulterer i fremstilling av et annet stoff (bruk av mellomprodukter).
- Kaliumoksyd brukes i områdene blanding og/eller landbruk, skogbruk og fiskeformulering. Det brukes til fremstilling av kjemikalier, plastprodukter og mineralprodukter (for eksempel gips, sement).
- Det brukes utendørs i langvarige materialer med lavhastighetsfrigjøring, for eksempel metall, tre og plastkonstruksjonsmaterialer.
- Interiør, langsiktige materialer brukes med lav hastighet, for eksempel møbler, leker, konstruksjonsmaterialer, gardiner, fottøy, lærprodukter, papir og pappprodukter, elektronisk utstyr.
- Dette stoffet finnes i produkter med steinbasert materiale, gips, sement, glass eller keramikk (for eksempel tallerkener, potter / panner, matlagringsbeholdere, konstruksjon og isolasjonsmateriale).
- Kaliumoksyd er en termisk stabil, svært uoppløselig kilde, egnet for glass, optiske og keramiske applikasjoner. Oksidforbindelser utfører ikke strøm.
- Det brukes også i lette strukturelle komponenter i romfart og elektrokjemiske applikasjoner som drivstoffbatterier der ionisk konduktivitet viser.
Referanser
- Amerikanske elementer (s.F.). Kaliumoksyd. Gjenopprettet fra amerikanementer.com.
- Dipassiumoksid. Gjenopprettet fra Echa.Europa.EU.

