Ammoniumacetatstruktur, egenskaper, bruksområder

- 4566
- 1334
- Prof. Joakim Johansen
Han Ammoniumacetat Det er et uorganisk salt hvis kjemiske formel er NH4Ch3COOH. Den stammer fra blandingen av eddiksyre, til stede i kommersiell eddik til en 5%konsentrasjon, og ammoniakk. Begge startstoffene har karakteristisk lukt, så det er mulig å få et inntrykk av hvorfor dette saltet lukter som eddik-ammonia.
Imidlertid er det mest høydepunktet av dette saltet ikke lukten, men det lave smeltepunktet. Det er så lavt at det i et hvilket som helst laboratorium kan oppnås i sin flytende versjon, der ioner flyter fritt for å transportere elektriske belastninger.
 Ammoniumacetatkrystaller. Kilde: Vidak [Public Domain].
Ammoniumacetatkrystaller. Kilde: Vidak [Public Domain]. På den annen side er ammoniumacetatet deilig; det vil si å absorbere miljøet eller fuktigheten i miljøet til det er fullstendig oppløst. Det er grunnen til at de, i vannfri tilstand, krystaller er hvite, blir raskt lyse (som de som er i begeret til det øvre bildet).
Å være en solid kilde til ammoniakk, må den manipuleres på en slik måte at innånding av vaporene minimeres. Men til tross for denne negative egenskapen, NH4Ch3COOH er nyttig for fremstilling av bufferløsninger som mat beholder, mens det er en komponent av visse løsningsmiddelproteinekstraktorer.
[TOC]
Ammoniumacetatstruktur
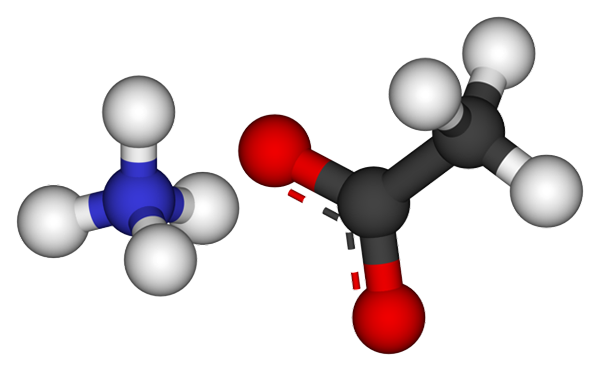 Ammoniumacetate ioner. Kilde: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Ammoniumacetate ioner. Kilde: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Det øvre bildet viser ionene som utgjør ammoniumacetatet i en kuler og bars -modell. Til venstre er den tetrahedriske geometri -kationen, NH4+, Mens du er på høyre side av molekylanionen med to demokerte elektroner mellom to oksygenatomer, CH3COO- (Den stiplede linjen mellom de røde kulene).
Dermed begge ionene, NH4+ og Ch3COO-, De forblir forent av sin elektrostatiske attraksjon at sammen med frastøttene mellom like belastninger ender opp med å definere en krystall. Denne ammoniumacetatkrystallen har en ortorrombisk struktur, som kan observeres i mikroskopiske prøver eller til og med synlige størrelser.
Kan tjene deg: ionisk lenke: egenskaper, hvordan det dannes og eksemplerIkke bare er det ioniske bindingen for dette saltet viktig, men det samme er hydrogenbroer. NH4+ Du kan donere opptil fire av disse broene; Det vil si at i hver av toppunktene til dets tetrahedron er det et oksygenatom fra et CHO3COO- Nabo (h3N+-H-OCH3).
I teorien skal krefter inne i krystaller da være veldig sterke; Men eksperimentelt skjer det motsatte, siden det smelter bare 114 ° C. Derfor kompenserer ikke hydrogenbroer for svakheten i deres ioniske binding, og heller ikke den lave retikulære energien til NH -ortorrhrombisk glass4Ch3COO.
Andre komposisjoner og vann
Det ble sagt i begynnelsen at ammoniumacetat er fremstilt ved å blande eddik og ammoniakksyre. Derfor kan salt også uttrykkes som: NH3Ch3COOH. Avhengig av sammensetningen kan andre strukturer oppnås: NH3· 2ch3COOH, O NH3· 5ch3COOH, for eksempel.
Det ble også nevnt at det absorberer nok fuktighet. Ved å gjøre det, inneholder det vannmolekyler i krystaller, som er hydrolysert og gir NH3 eller Ch3COOH; Og det er grunnen til at salt avgir en lukt av ammoniakk eller eddik.
Egenskaper
Fysisk utseende
Avgjørende hvite krystaller med en lukt av eddik og ammoniakk.
Molmasse
77,083 g/mol.
Tetthet
1.073 g/ml ved 25 ºC.
Smeltepunkt
114 ºC. Denne verdien er betydelig lavere sammenlignet med andre salter eller ioniske forbindelser. I tillegg mangler det et kokepunkt på grunn av dannelsen av ammoniakk, noe som antyder nedbrytning av salt.
Løselighet
143 g/100 ml ved 20 ºC. Legg merke til din ekstraordinære vannløselighet, som demonstrerer affiniteten som vannmolekyler føler på NH -ionene4+ og Ch3COO-, Hying dem i vandige kuler.
Kan tjene deg: Hume-Rothery RulesHans løselighet er ikke slik i mindre polare løsningsmidler. For eksempel i 100 ml metanol ved 15 ºC 7,89 g NH oppløses4Ch3COO.
Stabilitet
Det er deilig, så du bør unngå å lagre i våte rom. Mens du absorberer vann frigjør ammoniakk, og derfor dekomponerer det.
Pka
9.9.
Denne konstanten tilsvarer surheten i ammoniumionet:
NH4+ + B NH3 + Hb
Der Hb er en svak syre. Hvis B -basen er vannet, vil hydrolysereaksjonen være reaksjon:
NH4+ + H2Eller NH3 + H3ENTEN+
Der arter h3ENTEN+ Definer pH i løsningen.
På den annen side bidrar acetat også til ph:
Ch3COO- + H2Eller Ch3COOH + OH-
Dermed begge artene h3ENTEN+ Og åh- De nøytraliseres ved å gi en pH 7, nøytral. I følge Pubchem har imidlertid sterkt konsentrerte oppløsninger av ammoniumacetat en sur pH; Noe som betyr at NH -hydrolyse dominerer4+ Om valget3COO-.
Standard treningsentalpi
ΔFH298 = -615 kJ/mol.
applikasjoner
Analytisk
Vandige natriumacetatoppløsninger gjør at bly-, jern- og sinksulfater blir solubilisert, for deretter å bestemme deres konsentrasjon ved atomabsorpsjonsspektroskopi.
Halv sjåfør
Som måltider med lav temperatur sammenlignet med andre salter, kan væsken brukes til å drive den elektriske strømmen som slår på kretsen til en pære.
Buffer
Du kan regulere pH -endringer i sure eller grunnleggende intervaller, som brukes til å opprettholde en konstant pH i, for eksempel kjøtt, sjokolade, oster, grønnsaker eller andre matprodukter.
Kan tjene deg: molybdenPå is og gulv
Det er et biologisk nedbrytbart og relativt billig salt, som brukes til å tine isete stier. Fordi det er en kilde til vannoppløselig nitrogen, er den beregnet på landbruksbruk for bestemmelse av kaliumnivåer.
Utfellende middel
Dette saltet brukes til å utfelle protein for å utføre kromatografisk analyse.
Medisin
Ammoniumacetat fungerer som et veterinært vanndrivende middel, og det er også et nødvendig salt for insulin og penicillinsyntese.
Risiko
Neste og til slutt er noen negative risikoer eller konsekvenser forårsaket av ammoniumacetatet oppført:
- Det kan gi svake irritasjoner på huden, men uten å absorbere i den.
- Når du har inntatt, forårsaker mage, diaré, diurese, angst, større behov for å urinere, skjelvinger og andre symptomer relatert til ammoniakkforgiftning, samt skade leveren.
- Hans innånding irriterer nesen, halsen og lungene.
Av resten er det ukjent om kreft kan generere, og enhver mulig risiko for brann av dette saltet blir kastet (i det minste under normale lagringsforhold).
Referanser
- Inger Nahringbauer. (1967). Hydrogenbindingsstudier. Xiv. Krystallstrukturen til ammoniumacetat. Institute of Chemistry, University of Uppsala, Uppsala, Sverige. Krystall. 23, 956.
- Nasjonalt senter for bioteknologiinformasjon. (2019). Ammoniumacetat. PubChem -database. CID = 517165. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Sullivan Randy. (2012). Konduktivitet av ammoniumacetat. Gjenopprettet fra: Chemdemos.Uoregon.Edu
- VIACHEM, LTD. (s.F.). Ammoniumacetat. Gjenopprettet fra: vicheminc.com
- Wikipedia. (2019). Ammoniumacetat. Hentet fra: i.Wikipedia.org
- New Jersey Department of Health. (2012). Ammoniumacetat: Informasjonsark om farlige stoffer. [PDF]. Gjenopprettet fra: NJ.Gov
- Xueyanghu. (s.F.). Bruker og risikoer ved ammoniumacetat. Gjenopprettet fra: Xueyanghu.WordPress.com
- « Alizarinegenskaper, preparat, bruk og toksisitet
- Jernhydroksyd (III) struktur, egenskaper og bruk »

