Kaliumacetatstruktur, egenskaper, bruksområder
- 4040
- 368
- Prof. Oskar Aas
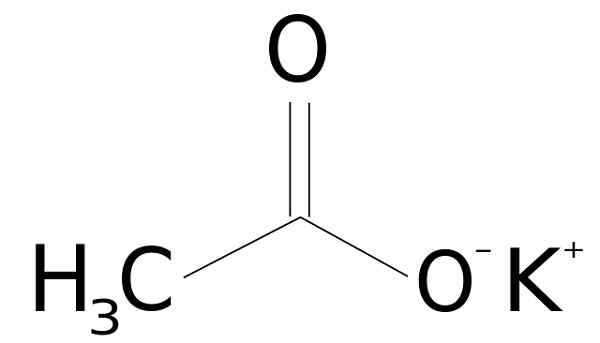
Han Kaliumacetat Det er en organisk forbindelse dannet av et ionekalium k+ og et ionacetato3COO-. Den kjemiske formelen er Cho3Kokk, eller kch3COO, eller også C2H3Ko2. Det er et fargeløst eller hvitt krystallinsk fast, veldig løselig i vann.
Det brukes til å regulere surheten i visse industrielt bearbeidede matvarer. På grunn av sin store tilknytning til vann, brukes det i laboratorier eller i visse prosesser for å absorbere vann fra andre forbindelser, for eksempel til dehydrate alkohol.
 KCH kaliumacetat3CO tjener til å regulere surheten i noen bearbeidet mat. Forfatter: Ritae. Kilde: Pixabay.
KCH kaliumacetat3CO tjener til å regulere surheten i noen bearbeidet mat. Forfatter: Ritae. Kilde: Pixabay. Kaliumacetat deltar i noen kjemiske reaksjoner som deres gasspedal og i syntesen av organiske forbindelser. Det tillater også økende antistoffdannelse (naturlige stoffer som bekjemper infeksjoner) i industrielle metoder for å produsere dem.
Egenskapene ved veldig lave temperaturer gjør det til en god kandidat som skal brukes i blandinger for å smelte is på betongveier i veldig kalde klima. I følge kilder som er konsultert, brukes det også i utstyr for å bekjempe branner og samlinger for å observere celler i mikroskop.
[TOC]
Struktur
Kaliumacetat dannes av et kaliumkation k+ og et anionacetat cho3COO-. Sistnevnte er den konjugerte basen av eddiksyre ch3COOH. Acetat Cho3COO- består av en metyl -ch3 sammen med et karboksylat -coo-.
Forbundet mellom begge ionene er elektrostatisk eller ionisk, det vil si foreningen mellom et positivt og et negativt ion.
 Kaliumacetatstruktur CH3kokk. Sssilver [Public Domain]. Kilde: Wikimedia Commons.
Kaliumacetatstruktur CH3kokk. Sssilver [Public Domain]. Kilde: Wikimedia Commons. Nomenklatur
- Kaliumacetat
- Kaliumetanoate
- Eddiksyre kaliumsalt
- Acok
- Koac
Egenskaper
Fysisk tilstand
Fargeløs fast eller krystallinsk hvit.
Molekylær vekt
98,14 g/mol
Smeltepunkt
292 ºC
Tetthet
1,6 g/cm3
Løselighet
Veldig løselig i vann: 256 g/100 ml ved 20 ° C.
Ph
En 5% vandig løsning av kaliumacetat har en pH på 7,5-9,0.
Andre egenskaper
Noen ganger har den en svak lukt av eddik. I 10% løsning angriper ikke aluminium ved romtemperatur, men ved 60-70 ° C mørkner metallet og lider bitt.
Ved konsentrasjoner på 20% eller mer oppstår overflateangrep på aluminium ved enhver temperatur.
Kan tjene deg: hydraceKaliumacetat (ACOK) er svært oppløselig i vann. Det har et hydrat: KCH3COO.1.5H2Eller, som er det faste stoffet som oppnås ved å krystallisere det fra de vandige ACOK -løsningene.
Atferd når du varmer
Hvis kaliumacetatet (ACOK) (KCH (KCH) blir sendt til oppvarming (KCH3COO.1.5H2O) Når du når 40 ° C, begynner hydreringsvann å tape.
KCH3COO.1.5H2O → KCH3COO + 1,5H2Eller ↑
Hvis det vannfrie kaliumacetatet blir oppvarmet (uten vann: KCH3COO), når du når 340 ° C, begynner det å dekomponere å danne kaliumkarbonat K2Co3 I henhold til følgende reaksjon:
2 kch3COO + 4 o2 → K2Co3 + 3 H2O + 3 CO2↑
Å skaffe
Det kan fremstilles ved virkningen av KOH kaliumhydroksid på flere forbindelser, for eksempel Cho Acid3COOH, eddikanhydrid (CH3Co)2O og ammoniumacetat cho3Poonh4.
KOH +CH3COOH → Ch3Kok + H2ENTEN
Det kan også oppnås ved å reagere kaliumkarbonat K2Co3 O KHCO kaliumbikarbonat3 Med eddiksyre CH3COOH.
KHCO3 + Ch3COOH → Ch3Kok +H2Eller + co2↑
Kaliumacetat kan krystalliseres fra en vandig løsning for å oppnå den med høy renhet.
applikasjoner
I flere applikasjoner
Kaliumacetat brukes i den bearbeidede matindustrien som en surhetsregulator. Det brukes som tørkemiddel i kjemiske metoder for å måle vanndampens permeabilitet av noen stoffer.
Det fungerer som et dehydrerende middel for etanol i produksjonen av denne alkoholen basert på lignocellulose, et materiale avledet fra tre.
Det brukes til å produsere antibiotika og brukes mye i brannkamputstyr.
I polymerindustrien
Det brukes til å resirkulere polyuretaner fordi det tjener til å katalysere eller akselerere hydrolyse og glykolysereaksjoner fra slike polymerer for å bli alkoholer og aminer.
Det brukes også i produksjonen av organiske silikonharpikser.
I vitenskapelige og medisinske forskningslaboratorier
Kaliumacetat med høy renhet brukes i laboratorier som et analytisk kjemi -reagens. Også for å drive medisinsk forskning.
Kan tjene deg: neon: historie, egenskaper, struktur, risiko, brukI histopatologilaboratorier tjener det for å sikre et nøytralt pH -medium i mikroskopenheter.
 Kaliumacetat har forskjellige bruksområder i kjemiske og medisinske forskningslaboratorier. Forfatter: Michal Jarmoluk. Kilde: Pixabay.
Kaliumacetat har forskjellige bruksområder i kjemiske og medisinske forskningslaboratorier. Forfatter: Michal Jarmoluk. Kilde: Pixabay. Det brukes til syntese av heterocykliske organiske forbindelser, som er forbindelser med sykluser av forskjellig størrelse.
Visse mikroelektroder som tjener til å studere de elektriske egenskapene til celler, er fylt med en konsentrert kaliumacetatoppløsning.
I industriell produksjon av antistoffer
Kaliumacetat serverer den store sammensatte produksjonen av monoklonale antistoffer (som er de som kommer fra samme stamcelle) i cellekulturer. Det gjør det mulig å stimulere syntese eller antistoffdannelse.
Antistoffer er stoffer produsert av noen blodceller for å bekjempe virus- eller bakterieinfeksjoner.
 Kunstnerisk antistoffbilde. KCH natriumacetat3CO tjener i produksjonen av antistoffer i store mengder. Blitzkrieg1982 [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.Selv om kaliumacetat (ACOK) hemmer eller forsinker cellevekst og reduserer celletettheten, øker antistoffproduktiviteten for hver celle.
Kunstnerisk antistoffbilde. KCH natriumacetat3CO tjener i produksjonen av antistoffer i store mengder. Blitzkrieg1982 [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.Selv om kaliumacetat (ACOK) hemmer eller forsinker cellevekst og reduserer celletettheten, øker antistoffproduktiviteten for hver celle.
 Antistoffangrep Tegning til noen bakterier. SA1590 [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Antistoffangrep Tegning til noen bakterier. SA1590 [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. I antihielo -blandinger
Kaliumacetat har blitt brukt i antihielo -blandinger (engelsk oversettelse Anti-ising) for å bruke dem til å smelte vei og sement fortau og dermed tillate sikker bruk av disse.
 På vinterstasjonen er veiene fylt med snø og is. Kaliumacetat kan være nyttig i slike tilfeller. Forfatter: s. Hermann & F. Richter. Kilde: Pixabay.
På vinterstasjonen er veiene fylt med snø og is. Kaliumacetat kan være nyttig i slike tilfeller. Forfatter: s. Hermann & F. Richter. Kilde: Pixabay. Kaliumacetatvalg (ACOK) for denne applikasjonen skyldes en 50% vandig løsning med ACOK -vekt er et Eutctic og har et fusjonspunkt på -62 ° C. Det betyr at selv ved temperaturer så lavt som -62 ° C, forblir løsningen smeltet.
En euttic er en homogen blanding av komponenter som har det minste smeltepunktet for alle mulige blandinger, inkludert rene komponenter.
Hvordan det fungerer som en antihielo
Kaliumacetat (ACOK) har en veldig god kapasitet til å smelte isen.
A -5 ° C er i stand til å smelte 11,5 kg is for hver kg ACOK. Denne egenskapen avtar ved å redusere temperaturen, men selv til -50 ° C har muligheten til å smelte 1,3 kg is for hver kg ACOH.
Kan tjene deg: krystallinske faste stoffer: struktur, egenskaper, typer, eksemplerA -5 ° C Denne kapasiteten er sammenlignbar med den for natriumklorid eller bordsalt (NaCl), mens fra -30 ° C FAR.
 Kaliumacetat lar deg smelte isen på frosne veier. Forfatter: Markus sch. Kilde: Pixabay.
Kaliumacetat lar deg smelte isen på frosne veier. Forfatter: Markus sch. Kilde: Pixabay. I testene ble imidlertid utført med ACOK sammen med andre forbindelser, en vis.
På den annen side er kaliumacetatblandingen (CH3Kokk) med kaliumforming (HCook) er en utmerket antielo og krever ikke antikorrosiv.
Referanser
- Baker, f.J. et al. (1976). Fargingsprosedyrer. Vandige monterende. I Introduksjon til Medical Laboratory Technology (Femte utgave). Gjenopprettet fra Scientedirect.com.
- Hassan, a.TIL. et al. (2018). Inzoles: Syntese og bindingsdannende heterocyklisering. I fremskritt innen heterocyklisk kjemi. Gjenopprettet fra Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Kaliumacetat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Das, a. og alagirusamy, r. (2010). Fuktsoverføring. Tørkemiddel omvendt koppmetode. I vitenskap i klær. Gjenopprettet fra Scientedirect.com.
- Vargel, c. (2004). Karboksilsyrer og derivater derav. Acetater. I korrosjon av aluminium. Gjenopprettet fra Scientedirect.com.
- Cuevas, J. (2014). Elektrofysiologiske opptaksteknikker. Intracellulære opptaksteknikker. I referansemodulasjon i biomedisinske vitenskaper. Gjenopprettet fra Scientedirect.com.
- Fink, j.K. (2018). Poly (uretan) s. Gjenvinning. Solvolyse. I Reactive Polymers: Fundamental and Applications (Third Edition). Gjenopprettet fra Scientedirect.com.
- Fong, w. et al. (1997). Optimalisering av monoklonal antistoffproduksjon: Kombinerte effekter av kaliumacetat og perfusjon i en omrørt tankbioreaktor. Cytoteknologi 24: 47-54. Lenke gjenopprettet.Springer.com.
- Danilov, v.P. et al. (2012). Anti-ising reagenser med lav temperatur i vandige saltsystemer som inneholder acetater og formiates. Teoretiske grunnlag for kjemisk ingeniørvitenskap, 2012, vol 46, nei. 5, s. 528-535. Lenke gjenopprettet.Springer.com.
- Fakeev, a.TIL.et al. (2012). Forskning og utvikling av metode for kaliumacetat med høy renhet. Journal of Applied Chemistry, 2012, vol. 85, nei.12, s. 1807-1813. Lenke gjenopprettet.Springer.com.
- « Magnetiske støtenheter, formler, beregning, eksempler
- Karakteristikk inndataenheter, hva er bruk, typer, eksempler »

