Aktinegenskaper, struktur, filamenter, funksjon
- 2868
- 30
- Thomas Karlsen
De Aktin Det er et cytosolisk protein som danner mikrofilamenter. I eukaryoter er aktin en av de mest tallrike proteiner. For eksempel representerer det 10 vekt% av det totale proteinet i muskelceller; og mellom 1 og 5% av proteinet i ikke -muskelceller.
Dette proteinet, ved siden av mellomliggende filamenter og mikrotubuli, danner cytoskjelettet, hvis hovedfunksjon er mobiliteten til cellen, vedlikehold av celleform, celledeling og bevegelse av organeller i planter, sopp og dyr.
 Kilde: sarkomere.SVG: David Richfield (Slashme User) Derivatarbeid: Retama [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]
Kilde: sarkomere.SVG: David Richfield (Slashme User) Derivatarbeid: Retama [CC BY-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]] Isoformer av aktincytoskelet.
Fra det evolusjonære synspunktet er aktin et sterkt bevart protein. Det er omtrent 90% sekvenshomologi i forskjellige arter. I encellede organismer koder et enkelt gen en actin isaform. Mens du er i flercellede organismer, koder for forskjellige gener flere aktin -isaformer.
Aktinen, sammen med myosin, var avgjørende strukturer i evolusjonær fremtid av eukaryote organismer og deres diversifisering, siden de tillot bevegelse i fravær av andre strukturer, for eksempel flagella og cilia.
[TOC]
Struktur: Aktinfilamenter
Aktin er en enkelt polypeptidkjede kuleprotein. I muskelen har aktinen en molekylmasse på omtrent 42 kDa.
Dette proteinet har to domener. Hver og en har to underdomener, og en spalte mellom domenene. ATP-MG+2 blir med i bunnen av kløven. Amino- og karboksilterminalene kommer sammen i underdomen 1.
Actina G og Actina f
Det er to hovedaktinformer: aktinmonomeren, kalt Actina G; og en filamentøs polymer, bestående av aktin G -monomerer, kalt Actina F. Aktinfilamenter, observert ved elektronisk mikroskopi, har henholdsvis smale og brede regioner, henholdsvis 7 nm og 9 nm i diameter.
Gjennom glødetråden danner aktinmonomerer en dobbel helix presset. En enhet som gjentas gjennom glødetråden består av 13 propeller og 28 aktinmonomerer, og har en avstand på 72 nm.
Aktinfilamentet har to ender. Man danner kløften som kobler ATP-MG+2, som ligger i samme retning i alle aktinmonomerer av glødetråden, kalt slutten (-); Og den andre enden er det motsatte, kalt slutten (+). Derfor sies det at aktinfilamentet har polaritet.
Mange ganger er disse komponentene kjent som mikrofilamenter, siden de er komponentene i cytoskjelettet som har mindre diameter.
Hvor finner vi aktin?
Actin er et ekstremt vanlig protein i eukaryote organismer. Av alle celleproteiner representerer aktin omtrent 5 til 10% - avhengig av celletype. I leveren, for eksempel, har hver av cellene som utgjør den nesten 5.108 Aktinmolekyler.
Kjennetegn
De to formene for aktin, monomer og filament finnes kontinuerlig i en dynamisk balanse mellom polymerisasjon og depolymerer. Generelt er det tre funksjoner i dette fenomenet:
1) Aktinfilamenter er typiske for strukturen til muskelvev og cytoskjelett av eukaryote celler.
Kan tjene deg: de 10 egenskapene til de mest fremragende lipidene2) Polymerisasjon og depolimerisering er en dynamisk prosess som er regulert. Der polymerisasjonen eller aggregeringen av G-ATP-MG aktinmonomerer+2 Det skjer i begge ender. At denne prosessen skjer, avhenger av forholdene til mediet og regulatoriske proteiner.
3) Dannelsen av bjelker og retikler, som utgjør aktincytoskjelett, gir kraft til cellemotilitet. Dette avhenger av proteiner som deltar i dannelsen av kryssbindinger.
Funksjoner
Muskelsammentrekning
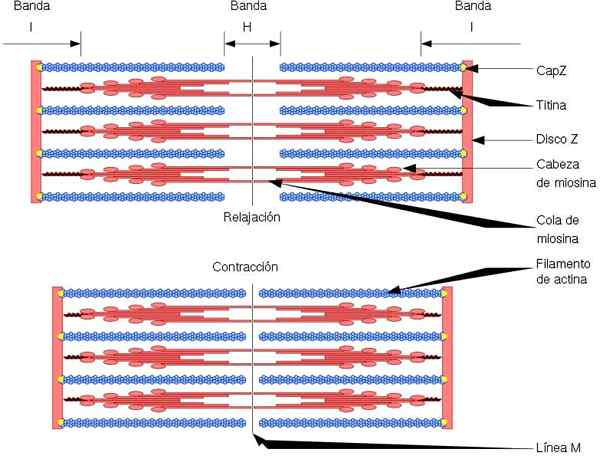
Den funksjonelle og strukturelle enheten til skjelettmuskelen er sarkomeren, som har to typer filamenter: tynne filamenter, dannet av aktin og tykke filamenter, dannet av myosin. Begge filamentene er organisert vekselvis, på en presis geometrisk måte. Tillat muskelsammentrekning.
Tynne filamenter er forankret til regioner som kalles plater z. Denne regionen består av et fibernettverk, der CAPZ -proteinet er lokalisert, og som endene (+) av aktinfilamenter er forankret. Dette ankeret forhindrer endedepolering (+).
På den annen side, i endene (-) av aktinfilamenter, er tropomodulin lokalisert og beskytter dem mot depolymersion. I tillegg til aktin, har tynne filamenter tropomiosin og troponin, som har funksjon av å kontrollere aktomiosininteraksjoner.
Hvordan oppstår muskelsammentrekning?
Under muskelsammentrekning gjør tykke filamenter svingbevegelser, og trekker de tynne filamentene mot midten av sarkomeren. Dette produserer gliden av de tykke og tynne fibrene.
Dermed forblir lengden på de tykke og tynne filamentene konstant, men øker overlappingen mellom begge filamentene. Lengden på sarkomeren avtar ved forankring av tynne filamenter til Z -skivene.
Hvordan stopper muskelkontraksjon?
ATP er energivalutaen til cellen. Derfor er det nesten alltid tilgjengelig i levende muskelvev. Når man tar hensyn til det ovennevnte, må det være mekanismer som tillater muskelavslapping og arrestasjon av sammentrekninger.
To proteiner, kalt tropomiosin og troponin, har en grunnleggende rolle i dette fenomenet. Disse samarbeider for å blokkere unionsstedene i myosin (og dermed forhindre deres forening med aktin). Som et resultat slapper muskelen ut.
Motsatt, når et dyr dør opplever et fenomen kjent som mortis strenghet. Personen som er ansvarlig for denne herding av kroppen er blokkeringen av samspillet mellom myosin og aktin, kort tid etter dyrets død.
En av konsekvensene av dette fenomenet er behovet for ATP for frigjøring av de to proteinmolekylene. Logisk sett er det ingen ATP -tilgjengelighet i døde stoffer, og denne utgivelsen kan ikke oppstå.
Andre typer bevegelse
Den samme mekanismen som vi beskriver (senere vil vi utdype mekanismen som ligger til grunn for bevegelse) er ikke begrenset til muskelkontraksjonene til dyr. Han er ansvarlig for ameboidale bevegelser som vi observerer i amøbasene og i noen koloniale form.
På samme måte ledes den cytoplasmatiske bevegelsen som vi observerer i alger og landplanter ledet av lignende mekanismer.
Regulering av polymerisasjon og depolymerisasjon av aktinfilament
Sammentrekningen av glatt muskelvev og celler gir en aktinøkning og en reduksjon i aktin G. Aktinpolymerisasjon skjer i tre trinn: 1) kjernefysning, et sakte trinn; 2) forlengelse, et raskt trinn; og 3) stabil status. Polymerisasjonshastighet er lik depolymerisasjonshastighet.
Kan tjene deg: Fixistteori: konsept, postulater og forfattereAktinfilamentet vokser raskere mot slutten (+) enn slutten (-). Forlengelseshastigheten er proporsjonal med konsentrasjonen av aktinmonomerer i likevekt med aktinfilamenter, kalt kritisk konsentrasjon (CC).
CC for slutten (+) er 0,1 um, og for slutten (-) er 0,8 um. Dette betyr at 8 ganger mindre konsentrasjon av aktinmonomerer er nødvendig for å polymerisere slutten (+).
Aktinpolymerisasjon er hovedsakelig regulert av beta4 -svindel (TB4). Dette proteinet forener aktin g og beholder det, og forhindrer polymeris. Mens propylin stimulerer aktinpolymerisasjon. Profil binder seg til aktinmonomerer som letter polymerisasjon etter slutten (+), ved dissosiasjon av Actin-TB4-komplekset.
Andre faktorer som ionøkning (NA+, K+ eller mg+2) favoriser dannelsen av filamenter.
Aktincytoskjelettdannelse
Dannelsen av aktincytoskjelett krever utdyping av kryssbindinger mellom aktinfilamenter. Disse koblingene danner proteiner, hvis høydepunkter er: de har unionsdomener til aktin; Mange har homologe domener til kalponin; og hver type protein uttrykkes i en viss type celle.
I filopoder og stressfibre blir kryssbindinger mellom aktinfilamenter laget av fascin og Philamine. Disse proteinene gjør henholdsvis aktinfilamenter parallelle eller har forskjellige vinkler. Derfor definerer aktinfilamenter formen på cellen.
Celleområdet med den høyeste mengden aktinfilamenter er lokalisert i nærheten av plasmamembranen. Denne regionen kalles cortex. Kortikal cytoskjelett er organisert i forskjellige former, avhengig av celletype, og kobles til plasmamembranen gjennom å fikse proteiner.
Noen av de best beskrevne cytoskeletons er muskelceller, blodplater, epitelceller og erytrocytter. For eksempel, i muskulære celler, forbinder dystrofinfiksativt protein aktinfilamenter til et omfattende glykoproteisk kompleks av membranen. Dette komplekset binder seg til ekstracellulære matriksproteiner.
Actin-Miosin interaksjonsmodell
Rament -ledede forskere foreslo en fire -trinns modell for å forklare interaksjonen mellom aktin og myosin. Det første trinnet oppstår med foreningen av ATP til myosinhoder. Denne foreningen genererer en konformasjonsendring i proteinet, og frigjør det fra aktin i det lille glødetråden.
Deretter hydrolyseres ATP til ADP, og slipper et uorganisk fosfat. Myosinmolekylet er forankret til en ny actin -underenhet, og genererer en høy energitilstand.
Frigjøring av uorganisk fosfat fører med seg en endring i myosin, og går tilbake til den første konformasjonen og bevegelsen av de små filamentene, med hensyn til de tykke filamentene, med hensyn til de tykke filamentene. Denne bevegelsen forårsaker bevegelse av de to endene av sarkomeren, og nærmer seg dem.
Det siste trinnet innebærer utgivelse av ADP. På dette tidspunktet er hodet til myosin gratis og kan bli med i et nytt ATP -molekyl.
Det kan tjene deg: Biologi: Historie, hvilke studier, grener, baserCellebevegelse drevet av aktinpolymerisasjon
Rektor bevegelighet er en type cellemotilitet. Trinnene for denne typen bevegelighet er: projeksjon av den ledende vedheftingsaksen til underlaget; vedheft til underlag; bakre tilbaketrekning; og des-vedheft.
Projeksjonen av den ledende aksen krever deltakelse av proteiner, som deltar i polymerisasjon og depolimerisering av aktinfilamenter. Den ledende aksen er lokalisert i cellebarken, kalt lamellipodio. Projeksjonstrinnene i aksen er:
- Reseptoraktivering med ekstracellulært signal.
- Dannelse av aktiv GTPASAS og 4,5-biskoposfatfosfoinositol (PIP2).
- WASP/SCAR og ARP2/3 proteinaktivering, som binder seg til aktinmonomerer for å danne konsekvenser i aktinfilamenter.
- Rask vekst av aktinfilamenter, på slutten dekorert med myosin, forgrening. Membranstøtet produseres fremover.
- Kulminasjon av forlengelse produsert av dekkproteiner.
- ATP -hydrolyse festet til aktin i de eldste filamentene.
- Depolimerisering av actin-AD av filamentene fremmet av ADF/Cofilina.
- ADP-utveksling av ATP katalysert av profylain, og genererer actin G-ATP klar til å starte elongar forgreninger.
Aktinrelaterte sykdommer
Muskeldystrofi
Muskeldystrofi er en degenerativ sykdom i skjelettmuskel. Det er arvet resessivt og er knyttet til X -kromosomet. Påvirker hovedsakelig menn med høy frekvens i befolkningen (en av 3.500 menn). Mødrene til disse mennene er asymptomatiske heterozygot, og kan mangle familiehistorie.
Det er to former for muskeldystrofi, Duchenne og Becker, og begge er forårsaket av defekter i dystrofingenet. Disse feilene består av slettinger som eliminerer aksoner.
Dystrophin er et protein (427 kDa) som danner kryssbindinger mellom aktinfilamenter. Det har en mestring av union til aktin i N-terminalen, og en mestring av membranforening i C-terminalen. Mellom begge domenene er det et tredje rørformet domene dannet av 24 tandem repetisjoner.
I muskel -kortikalt retikulum deltar dystrofin i foreningen av aktinfilamenter til plasmamembranen gjennom et glykoprotisk kompleks. Dette komplekset binder seg også til ekstracellulære matriksproteiner.
Hos pasienter som mangler funksjonell dystrofin, med Duchennes muskeldystrofi, støtter ikke kortikalt cytoskjelett plasmamembranen. Følgelig blir plasmamembranen skadet av stresset av gjentatte muskelsammentrekninger.
Referanser
- Devlin, t.M. 2000. Biokjemi. Redaksjonell reverté, Barcelona.
- Gunst, s.J., og Zhang, w. 2008. Aktincytoskeletal dynamisk i glatt muskel: et nytt paradigme for regulering av sammentrekning av glatt muskel. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, p., Baltimore, d., Darnell, J. 2003. Cellulær og molekylær biologi. Redaksjonell Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Nelson, d. L., Cox, m. M. 2008. Lehninger-prinsipper for biokjemi. W.H. Freeman, New York.
- Pfaendtner, J., Fra korset, og. M., Voth, g. 2010. Actin Filament Remodeling by Actin Depolymerization Factor/Cofilin. PNAS, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Cellulær bevegelighet drevet av montering og demontering av aktinfillamenter. Cell, 112: 453-465.
- « Apolipoproteiner hva er, funksjoner, typer
- Primær alkoholstruktur, egenskaper, nomenklatur, eksempler »

