Primær alkoholstruktur, egenskaper, nomenklatur, eksempler

- 3280
- 787
- Theodor Anders Hopland
EN Primær alkohol Det er en der hydroksylgruppen er knyttet til et primært karbon; Dette er et kovalent festet karbon til et annet karbon og hydrogener. Hans generelle formel er ROH, spesielt RCH2Å, siden det bare er en leiegruppe r.
RCH Formula R -gruppen R2Å det kan være hvem som helst: en kjede, en ring eller heteroatomer. Når det gjelder en kjede, kort eller lang, er det før de mest representative primære alkoholer; Blant dem er metanol og etanol, to av de mest syntetiserte på industrielt nivåer.
 Ølkrukke: Et eksempel på en vandig løsning av etylalkohol, en primær alkohol, i en organisk matrise. Kilde: Engin Akyurt via Pexels.
Ølkrukke: Et eksempel på en vandig løsning av etylalkohol, en primær alkohol, i en organisk matrise. Kilde: Engin Akyurt via Pexels. Fysisk er de som andre alkoholer, og deres kokende eller fusjonspunkter avhenger av graden av deres konsekvenser; Men kjemisk er de de mest reaktive. I tillegg er surheten overlegen den for sekundære og tertiære alkoholer.
Primære alkoholer opplever oksidasjonsreaksjoner, og blir et bredt antall organiske forbindelser: estere og etere, aldehyder og karboksylsyrer. De kan også lide dehydreringsreaksjoner, bli alkener eller olefiner.
[TOC]
Struktur av en primær alkohol
Primære alkoholer avledet fra lineære alkaner er de mest representative. Imidlertid kan enhver struktur, enten lineær eller forgrenet, klassifiseres innenfor denne typen alkoholer så lenge OH -gruppen er knyttet til en CH2.
Så strukturelt alle har til felles tilstedeværelsen av gruppen -ch2Å, kalt metylol. En egenskap og konsekvens av dette faktum er at OH -gruppen er mindre forhindret; det vil si at det kan samhandle med miljøet uten andre atomer som hindrer romlig.
Også en mindre forhindret OH betyr at karbonatomet som bærer det, velg2, kan lide erstatningsreaksjoner gjennom en SN -mekanisme2 (Bimolekylær, uten dannelse av en karbokasjon).
På den annen side oversetter en OH med større frihet til å samhandle med miljøet, som sterkere intermolekylære interaksjoner (ved hydrogenbroer), som igjen øker fusjonen eller kokepunktene.
Det kan tjene deg: Nikkelhydroksid (III): Struktur, egenskaper, bruksområder, risikoDet skjer også med sin løselighet i polare løsningsmidler, så lenge gruppe R ikke er veldig hydrofobisk.
Egenskaper
Surhet
Primære alkoholer er fra alle de mest sure. For at en alkohol skal oppføre seg som en Brnsted -syre, må en ion h donere+ til midten, å si vann, å bli en alcoxide -anion:
ROH + H2GULL- + H3ENTEN+
Den negative belastningen på den røde-, Spesielt av RCH2ENTEN-, Føler mindre frastøtning fra elektronene til de to C-H-bindingene, enn av elektronene i C-R-bindingen.
Leiegruppen utøver deretter den største frastøtningen, destabiliserer RCH2ENTEN-; men ikke så mye sammenlignet med det faktum at hvis det er to eller tre R -grupper, som tilfellet er med henholdsvis sekundære og tertiære alkoholer.
En annen måte å forklare den største surheten i en primær alkohol er gjennom forskjellen i elektronegativitet, og skaper dipolmomentet: H2CΔ+-ENTENΔ-H. Oksygen tiltrekker seg elektronisk tetthet begge CH2 som av H; Den positive delvise belastningen av karbon frastøter litt hydrogen.
Gruppe R overfører litt av dens elektroniske tetthet til CHO2, Noe som hjelper til med å redusere den positive delvise belastningen og med den frastøtningen for belastningen av hydrogen. Jo flere RA -grupper, jo lavere frastøtning, og derfor er trenden med H som skal frigjøres som H+.
Pka
Primære alkoholer anses som svakeste syrer enn vann, med unntak av metylalkohol, som er litt sterkere. PKA av metylalkohol er 15,2; Og PKA av etylalkohol er 16.0. I mellomtiden er vannet PKA 15,7.
Imidlertid kan vann som regnes som en svak syre, som alkoholer, bli med H+ Å transformere til hydriumion, h3ENTEN+; det vil si at det oppfører seg som en base.
På samme måte kan primære alkoholer fange hydrogen; Spesielt i noen av reaksjonene som er sine egne, for eksempel i deres transformasjon til alkener eller olefiner.
Kjemiske reaksjoner
Lei Halogenuros -formasjon
Alkoholer reagerer med hydrogenhalogenider for å produsere alkylhalogenider. Reaktiviteten til alkoholene foran hydrogenhalogenidene, stiger ned i følgende rekkefølge:
Kan tjene deg: karbonTertiær alkohol> Sekundær alkohol> Primær alkohol
ROH +HX => RX +H2ENTEN
Rx er et primært alkylhalogenid (velg3Cl, kap3Ch2BR osv.).
En annen måte å tilberede alkylhalogenuros er gjennom reaksjonen av tioniloklorid, et syntetisk reagens, med en primær alkohol som blir et alkylklorid. Tioniloklorid (SOCL2) krever å reagere tilstedeværelsen av pyridin.
Ch3(Ch2)3Ch2OH +SOCL2 => Ch3(Ch2)3Ch2Cl +Så2 + HCl
Denne reaksjonen tilsvarer halogenering av 1-penol for å bli 1-clloropentano i nærvær av pyridin.
Oksidasjon av primære alkoholer
Alkoholer kan oksideres til aldehyder og karboksylsyrer, avhengig av reagens. Pyridiniumklorokromat (PCC) oksiderer primær alkohol til aldehyd, ved bruk av diklormetan som et løsningsmiddel (CH2Cl2):
Ch3(Ch2)5Ch2Oh => cho3(Ch2)5COH
Dette er oksidasjon av 1-heptanol i 1-heptanal.
I mellomtiden er kaliumpermanganat (KMNO4) Alkohol alkohol først, og deretter oksidert til aldehydet til karboksylsyre. Når kaliumpermanganatet brukes til å oksidere alkoholer, bør brudd på koblingen mellom karbon og 4 unngås.
Ch3(Ch2)4Ch2Oh => cho3(Ch2)4COOH
Dette er oksidasjon av 1-heksanol til heksansyre.
Ved denne metoden er det vanskelig å oppnå et aldehyd, siden det lett oksiderer en karboksylsyre. En lignende situasjon blir observert når kromsyre brukes til å oksidere alkoholer.
E éteres formasjon
Primære alkoholer kan bli etere når de blir oppvarmet i nærvær av en katalysator, vanligvis svovelsyre:
2 rch2Oh => rch2Och2R +h2ENTEN
Organiske esarer -formasjon
Kondensasjonen av en alkohol og en karboksylsyre, Fisher -forestring, katalysert av en syre, produserer en ester og vann:
Kan tjene deg: karbokasjon: dannelse, egenskaper, typer, stabilitetR'oh +rcooh rcoor ' +h2ENTEN
En kjent reaksjon er etanol med eddiksyre, for å gi etylacetat:
Ch3Ch2Oh +Ch3COOH CH3Coohch2Ch3 + H2ENTEN
Primær alkohol er den mest utsatt for Fischer -sterifiseringsreaksjoner.
Dehydrering
Ved høye temperaturer og i et surt medium, vanligvis svovelsyre, dehydrater for å forårsake alkener med tap av et vannmolekyl.
Ch3Ch2Oh => h2C = Ch2 + H2ENTEN
Dette er dehydreringsreaksjonen av etanol til etylen. En mer passende generell formel for denne typen reaksjoner, spesielt for en primær alkohol, ville være:
Rch2Oh => r = cho2 (Det som også er lik RC = CH2)
Nomenklatur
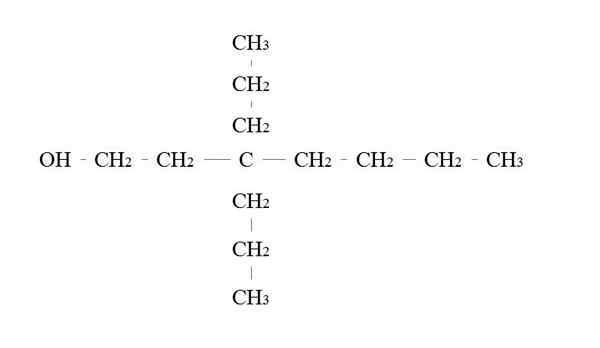 Primært alkoholeksempel. Kilde: Gabriel Bolívar.
Primært alkoholeksempel. Kilde: Gabriel Bolívar. Reglene for å navngi en primær alkohol er de samme som for de andre alkoholene; Med unntak at det noen ganger ikke er nødvendig å oppregne transportøren av OH.
I det øvre bildet er det en hovedstol -karbonkjede. Karbon knyttet til OH tildeles nummeret på 1, og deretter begynner det å telle fra venstre mot høyre. Dets IUPAC-navn er derfor: 3,3-dietilheptanol.
Merk at dette er et eksempel på en høyt forgrenet primær alkohol.
Eksempler
Til slutt blir noen primære alkoholer nevnt i henhold til deres tradisjonelle og systematiske nomenklatur:
-Metyl, kap3Åh
-Ethyl, Ch3Ch2Åh
-N-Propyl, Ch3Ch2Ch2Åh
-N-HEXYL, CH3Ch2Ch2Ch2Ch2Ch2Åh
Disse er avledet fra lineære alkaner. Andre eksempler er:
-2-fenyletanol, ca6H5Ch2Ch2Å (c6H5 = benzenring)
-2-Propen-1-OC (allilicalkohol), Cho2= Chch2Åh
-1,2-taodiol, kap2Ohch2Åh
-2-kloroetanol (etyleklorhydrin), clch2Ch2Åh
-2-buten-1-ol (crotilal alkohol), CH3CH = chch2Åh
Referanser
- Morrison, r.T. Og Boyd, r. N. (1987). Organisk kjemi. (5ta Utgave). Addison-Wesley Iberoamericana
- Carey, f. TIL. (2008). Organisk kjemi. (6ta Utgave). McGraw-Hill, Intermerica, redaktører S.TIL.
- Mel Science. (2019). Hvordan oksidasjon av primære alkoholer foregår. Gjenopprettet fra: melscience.com
- Royal Society of Chemistry. (2019). Definisjon: Primære alkoholer. Gjenopprettet fra: RSC.org
- Chriss e. McDonald. (2000). Oksidasjonen av primære alkoholer til estere: tre relaterte undersøkelseseksperimenter. J. Chem. Utdanning., 2000, 77 (6), s 750. Doi: 10.1021/ED077P750
- « Aktinegenskaper, struktur, filamenter, funksjon
- Diamagnetisme materialer, applikasjoner, eksempler »

